Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo đề bài ta có : \(\left\{{}\begin{matrix}nNO=\dfrac{0,224}{22,4}=0,01\left(mol\right)\\nHNo3=\dfrac{33.21}{100.63}=0,11\left(mol\right)\end{matrix}\right.\)
PTHH :
(1) \(Fe+4HNO3->Fe\left(NO3\right)3+NO\uparrow+H2O\)
0,01mol...0,04mol....................................0,01mol
(2) \(Fe2O3+6HNO3->2Fe\left(NO3\right)3+3H2O\)
a) khối lượng của Fe và Fe2O3 trong hỗn hợp ban đầu là : \(\left\{{}\begin{matrix}mFe=0,01.56=0,56\left(g\right)\left(g\right)\\mFe2O3=2,16-0,56=1,6\left(g\right)\end{matrix}\right.\)
b) nồng độ % các chất trong dung dịch sau phản ứng là :
Theo PTHH 2 ta có : nFe(NO3)2 = 2nFe2O3 =2 \(\dfrac{1,6}{160}=0,02\left(mol\right)\)
=> C%\(_{\text{dd}Fe\left(NO3\right)3}=\dfrac{\left(0,01+0,02\right).242}{2,16+33-0,01.30}.100\%\approx20,83\%\)
Vậy...

a, \(n_{Cu}=\dfrac{9,6}{64}=0,15\left(mol\right)\)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Mol: 0,15 0,15 0,1
\(V_{NO}=0,1.22,4=2,24\left(l\right)\)
b, \(C_{M_{ddCu\left(NO_3\right)_2}}=\dfrac{0,15}{0,2}=0,75M\)

a) nNO = 0,03 mol
Gọi số mol của Fe và Cu lần lượt là x, y ta có:
\(\left\{{}\begin{matrix}56x+64y=2,48\\3x+2y=0,03.3=0,09\end{matrix}\right.\) <=> \(\left\{{}\begin{matrix}x=0,01\\y=0,03\end{matrix}\right.\)
Suy ra: mFe = 0,56 g ; mCu = 1,92 g
b) nHNO3 = 4nNO = 0,12 mol => CM = 0,6 M
c) mmuối = mKL + 3nNO.62 = 8,06 (g)

Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
Ta có hệ:
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)

a)
\(n_{NO} = 0,01(mol)\)
Bảo toàn electron : \(2n_{Cu} = 3n_{NO}\)
\(\Rightarrow n_{Cu} = 0,015(mol)\)
Vậy :
\(\%m_{Cu} = \dfrac{0,01.64}{1,98}.100\% = 32,32\%\\ \%m_{Al_2O_3} = 100\% - 32,32\% = 67,68\%\)
b)
\(n_{Al_2O_3} = \dfrac{1,98-0,015.64}{102} = 0,01(mol)\)
\(n_{OH^-} = n_{NaOH} + 2n_{Ba(OH)_2} = 0,1.1 + 0,5.0,1.2 = 0,2(mol)\)
Ta có :
\(n_{Cu(NO_3)_2} = n_{Cu} = 0,015(mol)\\ n_{Al(NO_3)_3} = 2n_{Al_2O_3} = 0,02(mol)\)
Mà : \(n_{OH^-} = 4n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} + n_{HNO_3\ dư}\)
\(\Rightarrow n_{HNO_3\ dư} = 0,09(mol)\)
Bảo toàn nguyên tố với N :
\(n_{HNO_3\ pư} = 3n_{Al(NO_3)_3} + 2n_{Cu(NO_3)_2} = 0,06(mol)\)
Vậy, \(V = \dfrac{0,09 + 0,06}{1} = 0,15(lít)\)

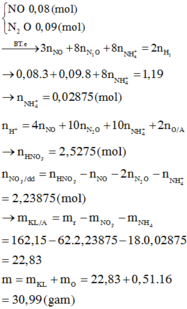
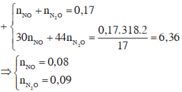
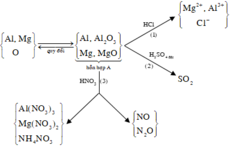

Fe + 4HNO3 -> Fe(NO3)3 + NO + 2H2O (1)
Al2O3 + 6HNO3 -> 2Al(NO3)3 + 3H2O (2)
nNO=0,1(mol)
Theo PTHH 1 ta có:
nFe=nNO=0,1(mol)
mFe=56.0,1=5,6(g)
%mFe=\(\dfrac{5,6}{15,8}.100\%=35,443\%\)
%mAl2O3=100-35,443=64,557%
b;
nAl2O3=\(\dfrac{15,8-5,6}{102}=0,1\left(mol\right)\)
Theo PTHH 1 ta có:
nHNO3(1)=4nFe=0,4(mol)
nFe(NO3)3=nFe=0,1(mol)
Theo PTHH 2 ta có:
nHNO3(2)=6nAl2O3=0,6(mol)
nAl(NO3)3=2nAl2O3=0,2(mol)
Vdd HNO3=\(\dfrac{0,4+0,6}{2}=0,5\left(lít\right)\)
CM dd Fe(NO3)3=\(\dfrac{0,1}{0,5}=0,2M\)
CM dd Al(NO3)3=\(\dfrac{0,2}{0,5}=0,4M\)
ko phải thầy đâu,em mới lớp 9 thua cả chị đấy,gọi là em dc rồi
Nguyễn Kiều Trang