Trộn 300 ml dung dịch HCl 0,5M với 200 ml dung dịch Ba(OH)2 a mol/lit thu được 500 ml dung dịch có pH = 1. Tính giá trị của a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
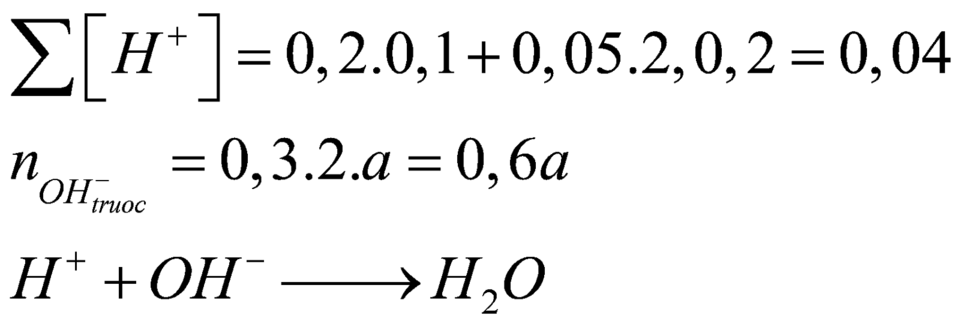
Mà sau phản ứng thu được dung dịch bazo có ph=13 (500ml)nên ta có
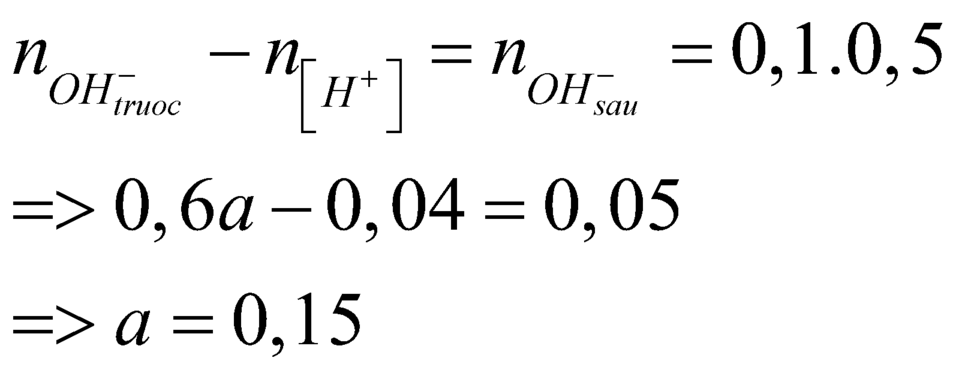
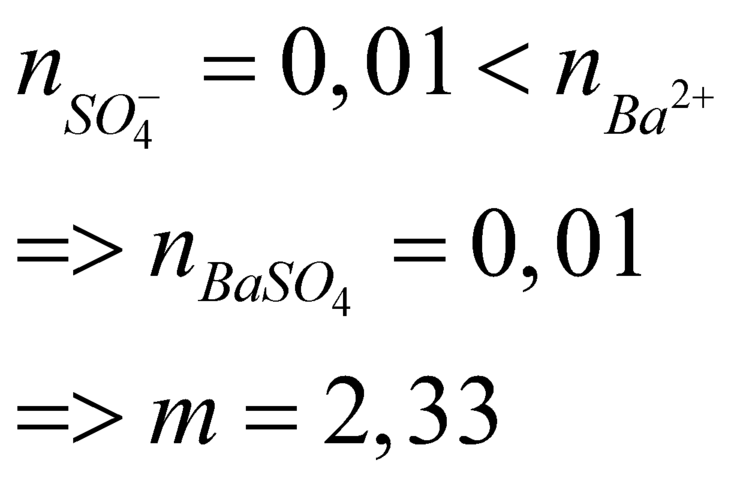

Đáp án B
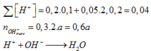
Mà sau phản ứng thu được dung dịch bazo có ph=13 (500ml)nên ta có
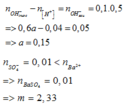

a, \(n_{H^+}=0,025.0,2=0,005\left(mol\right)\)
\(n_{OH^-}=0,01.2.0,3=0,006\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,001\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]_{dư}=\dfrac{0,001}{1}=10^{-3}\)
\(\Rightarrow\left[H^+\right]=10^{-11}\)
\(\Rightarrow pH=11\)
b, \(n_{Fe^{2+}}=n_{SO_4^{2-}}=0,02.0,1=0,002\left(mol\right)\)
\(n_{Ba^{2+}}=0,01.0,3=0,003\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{BaSO_4\downarrow}=n_{SO_4^{2-}}=0,002\left(mol\right)\\n_{Fe\left(OH\right)_2\downarrow}=n_{OH^-dư}=0,001\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,002.233+0,001.90=0,556\left(g\right)\)

Ta có
\(\text{nHCl=0,2.0,1=0,02(mol)}\)
\(\text{nH2SO4=0,2.0,05=0,01(mol)}\)
2HCl+Ba(OH)2\(\rightarrow\)BaCl2+2H2O
H2SO4+Ba(OH)2\(\rightarrow\)BaSO4+2H2O
Ta có pH=13\(\rightarrow\)Ba(OH)2 dư
pH=13\(\rightarrow\)pOH=1\(\Rightarrow\)CM[OH-]=0,1(M)
\(\rightarrow\)CMBa(OH)2 dư=0,05(M)
\(\text{nBa(OH)2 dư=0,05.0,5=0,025(mol)}\)
\(\text{m=0,01.233=2,33(g)}\)
nBa(OH)2=0,025+0,02/2+0,01=0,045(mol)
\(\rightarrow\)a=\(\frac{0,045}{0,3}\)=0,15(M)


\(n_{H^+}=n_{HCl}=0,5.0,3=0,15\left(mol\right)\\ n_{OH^-}=2.n_{Ba\left(OH\right)_2}=0,2.a.2=0,4a\left(mol\right)\\ Vì:pH=1\Rightarrow-log\left[H^+\right]=1\\ \Leftrightarrow\left[H^+\right]=0,1\left(M\right)\\ \Rightarrow\dfrac{n_{H^+\left(dư\right)}}{0,5}=0,1\\ \Rightarrow n_{H^+\left(dư\right)}=0,05\left(mol\right)\\ \Rightarrow0,15-0,4a=0,05\\ \Leftrightarrow a=0,25\)