Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al+ 3H2SO4-> Al2(SO4)3 +3H2
2a 3a Zn+H2SO4 -> ZnSO4 +H2 b b Theo bài ra ta có b=3a => a:b= 1:3
Gọi \(n_{H_2}=x\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}x\) x ( mol )
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(x\) x ( mol )
\(a:b=\dfrac{\dfrac{2}{3}x.27}{65x}=\dfrac{18x}{65x}=\dfrac{18}{65}\)
Hòa tan m1 (g) Al và m2 (g) Zn bằng dd HCl dư thu được những thể tích H2 như nhau. Tính tỉ lệ m1: m2

giả sử đều sinh ra 1(mol) h2
pthh:
2Al+6HCl..==>2AlCl3.+3H2
2/3....................................1
Zn+2HCl...==>..ZnCl2.+.H2
1......................................1
m1:m2=18:65

Giả sự đều sinh ra 1 mol H2
2Al+3H2SO4--->Al2(SO4)3+3H2
2/3_______________________1
=>a=2/3.27=18
Zn+H2SO4--->ZnSO4+H2
1___________________1
=>b=65
===> a/b=18/65

$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{Al} = \dfrac{a}{27} (mol) \Rightarrow n_{H_2} = \dfrac{3}{2}n_{Al} = \dfrac{a}{18}(mol)$
$n_{Zn} = \dfrac{b}{65}(mol) \Rightarrow n_{H_2} = n_{Zn} = \dfrac{b}{65}(mol)$
$\Rightarrow \dfrac{a}{18} = \dfrac{b}{65}$
$\Rightarrow \dfrac{a}{b} = \dfrac{18}{65}$

Cô sẽ chữa bài này như sau:
2Al+ 3H2SO4-> Al2(SO4)3 +3H2
a/27 ------------------------------a/18 Zn+H2SO4 -> ZnSO4 +H2 b/65 ----------------------b/65 a/18=b/65 <=> a=18b/65
Ta có: \(n_{H_2O}=\dfrac{8,1}{18}=0,45\left(mol\right)\)
⇒ n O (trong oxit) = 0,45 (mol)
Có: m oxit = mM + mO ⇒ mM = 24 - 0,45.16 = 16,8 (g)
Giả sử kim loại M có hóa trị n khi tác dụng với H2SO4.
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,6}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{16,8}{\dfrac{0,6}{n}}=28n\)
Với n = 1 ⇒ MM = 28 (loại)
Với n = 2 ⇒ MM = 56 (nhận)
Với n = 3 ⇒ MM = 84 (loại)
⇒ M là Fe. ⇒ Oxit cần tìm là FexOy.
PT: \(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}n_{H_2O}=\dfrac{0,45}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{24}{\dfrac{0,45}{y}}=\dfrac{160}{3}y\)
\(\Rightarrow56x+16y=\dfrac{160}{3}y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit đó là Fe2O3.
Bạn tham khảo nhé!

Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)
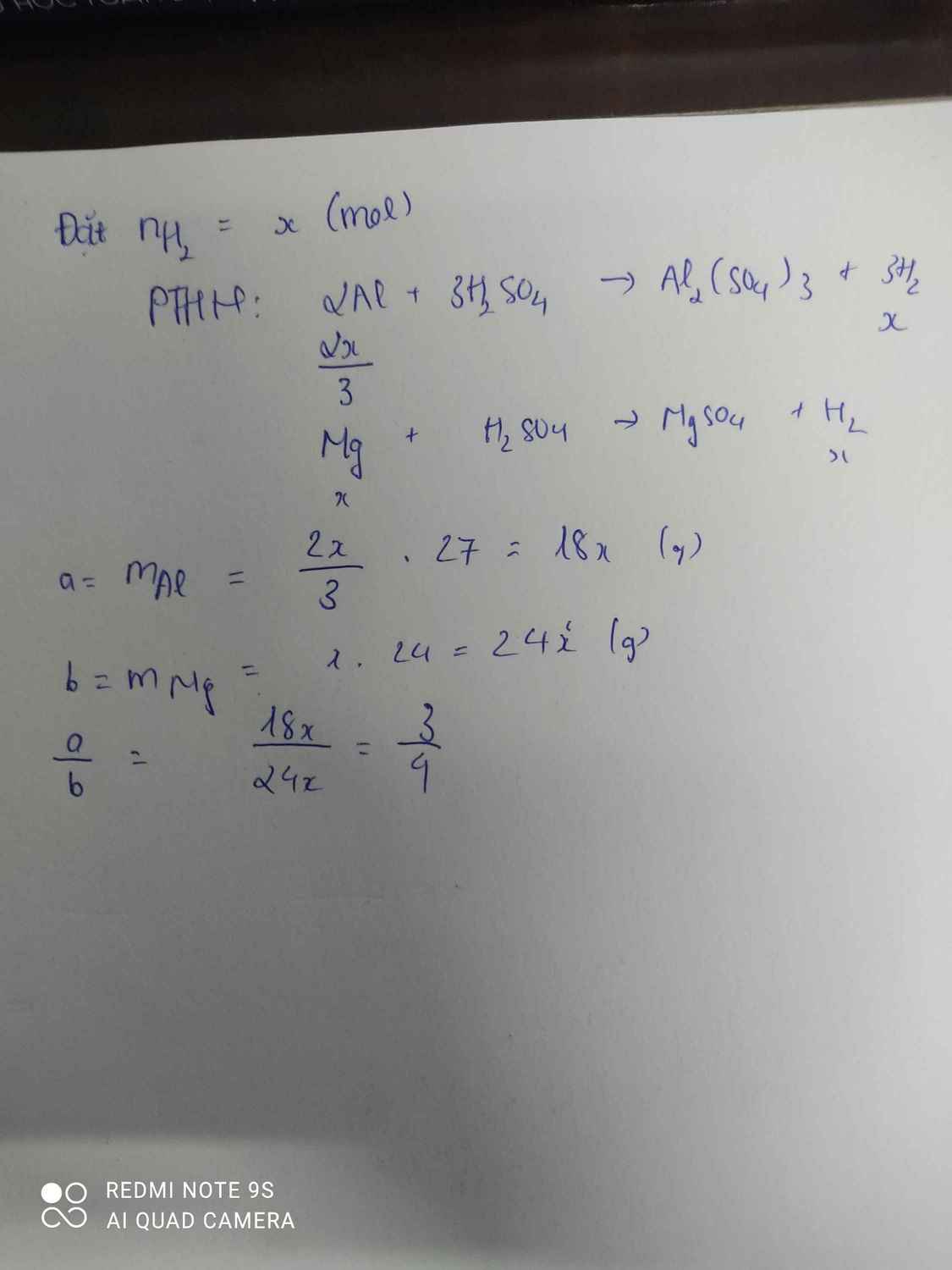
Giả sử có 1 mol \(H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}\) 1 1 ( mol )
\(m_{Al}=\dfrac{2}{3}.27=18g\)
\(m_{H_2SO_4}=1.98=98g\)
\(a:b=\dfrac{18}{98}=\dfrac{9}{49}\)