
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

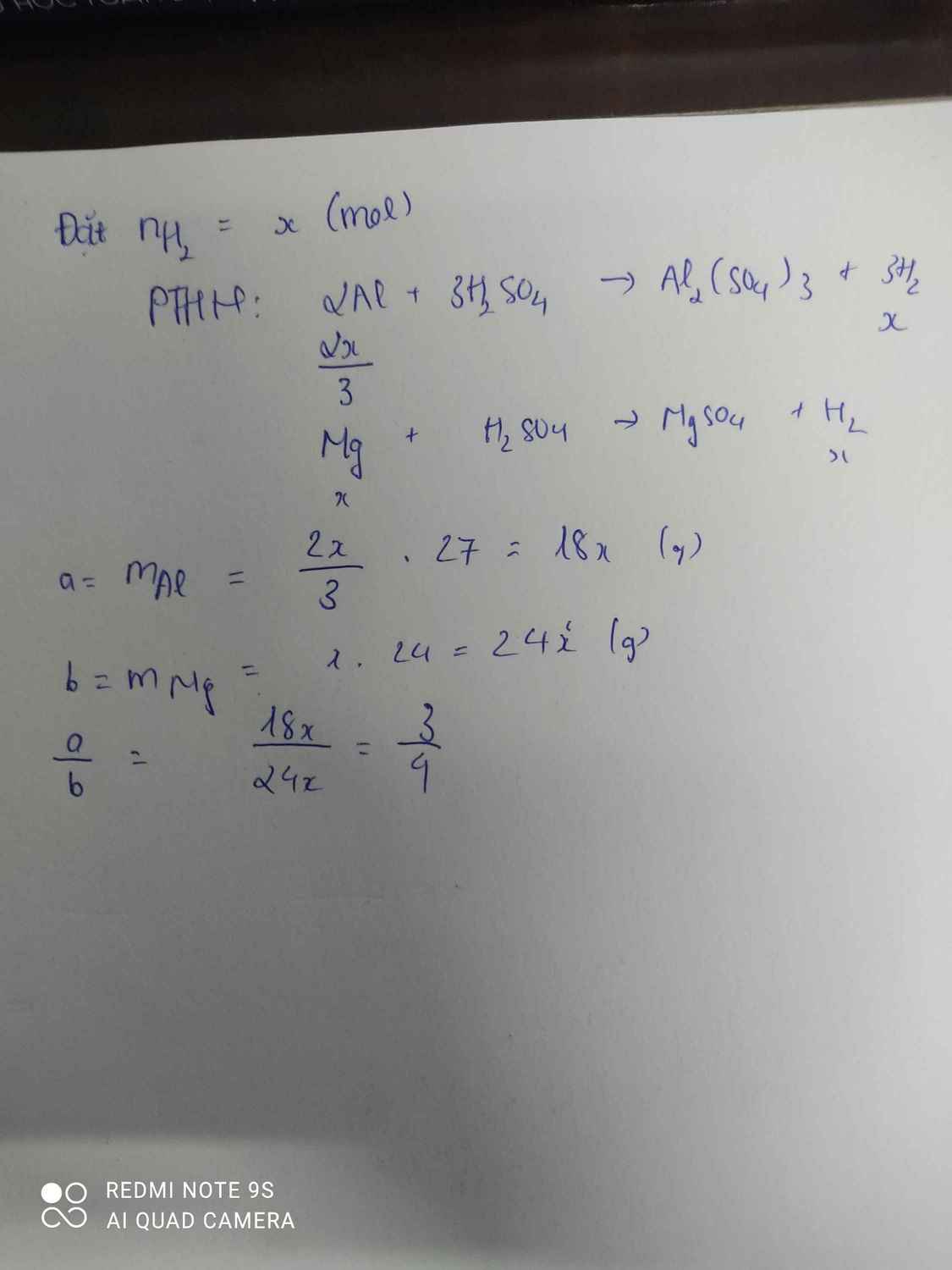

Gọi \(n_{H_2}=x\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}x\) x ( mol )
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(x\) x ( mol )
\(a:b=\dfrac{\dfrac{2}{3}x.27}{65x}=\dfrac{18x}{65x}=\dfrac{18}{65}\)

$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{Al} = \dfrac{a}{27} (mol) \Rightarrow n_{H_2} = \dfrac{3}{2}n_{Al} = \dfrac{a}{18}(mol)$
$n_{Zn} = \dfrac{b}{65}(mol) \Rightarrow n_{H_2} = n_{Zn} = \dfrac{b}{65}(mol)$
$\Rightarrow \dfrac{a}{18} = \dfrac{b}{65}$
$\Rightarrow \dfrac{a}{b} = \dfrac{18}{65}$

Giả sự đều sinh ra 1 mol H2
2Al+3H2SO4--->Al2(SO4)3+3H2
2/3_______________________1
=>a=2/3.27=18
Zn+H2SO4--->ZnSO4+H2
1___________________1
=>b=65
===> a/b=18/65

TN1: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{Fe}=\dfrac{m_1}{56}\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=\dfrac{m_1}{56}\left(mol\right)\)
TN2: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{m_2}{27}\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{m_2}{18}\left(mol\right)\)
Mà: \(V_2=1,5V_1\Rightarrow\dfrac{V_1}{V_2}=\dfrac{1}{1,5}=\dfrac{2}{3}\)
\(\Rightarrow\dfrac{n_1}{n_2}=\dfrac{n_{H_2\left(Fe\right)}}{n_{H_2\left(Al\right)}}=\dfrac{2}{3}\) \(\Rightarrow\dfrac{\dfrac{m_1}{56}}{\dfrac{m_2}{18}}=\dfrac{2}{3}\)
\(\Rightarrow\dfrac{m_1}{m_2}=\dfrac{56}{27}\)

2Al+6HCl-->2AlCl3+3H2 (1)
Zn+2HCl-->ZnCl2+H2 (2)
Gọi số mol của H2 ở 2 pt là a(mol)
Số mol của Al là:
nAl=2/3nH2=2/3.a(mol)
K/lượng của Al là:
m=n.M=2/3a.27=18a(g)
Số mol của Zn là:
nZn=nH2=a(mol)
K/lượng của Zn là:
m=n.M=a.65(g)
Tỉ lệ a,b là:
a/b=mAl/mZn=18a/65a=18/65
Vậy tỉ lệ a/b là 18/65

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)

\(n_{Mg}=\dfrac{6}{24}=0,25(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ a,n_{H_2}=n_{Mg}=0,25(mol)\\ \Rightarrow V_{H_2}=0,25.22,4=5,6(l)\\ b,PTHH:CuO+H_2\xrightarrow{t^o}Cu+H_2O\\ \Rightarrow n_{Cu}=n_{H_2}=0,25(mol)\\ \Rightarrow m_{Cu}=0,25.64=16(g)\)

Giả sử có 1 mol \(H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}\) 1 1 ( mol )
\(m_{Al}=\dfrac{2}{3}.27=18g\)
\(m_{H_2SO_4}=1.98=98g\)
\(a:b=\dfrac{18}{98}=\dfrac{9}{49}\)

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,2 0,2 0,2 0,2
a)\(V_{H_2}=0,2\cdot22,4=4,48l\)
b)\(m_{ZnSO_4}=0,2\cdot161=32,2g\)
\(m_{ddZnSO_4}=30+200-0,2\cdot2=229,6g\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{32,2}{229,6}\cdot100\%=14,02\%\)
c)\(n_{CuO}=\dfrac{24}{80}=0,3mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,3 0,2 0,2
\(m_{rắn}=m_{Cu}=0,2\cdot64=12,8g\)
nZn=1365=0,2molnZn=1365=0,2mol
Zn+H2SO4→ZnSO4+H2Zn+H2SO4→ZnSO4+H2
0,2 0,2 0,2 0,2
a)VH2=0,2⋅22,4=4,48lVH2=0,2⋅22,4=4,48l
b)mH2SO4=0,2⋅98=19,6gmH2SO4=0,2⋅98=19,6g
C%=mctmdd⋅100%=19,6200⋅100%=9,8%C%=mctmdd⋅100%=19,6200⋅100%=9,8%
c)nCuO=2480=0,3molnCuO=2480=0,3mol
CuO+H2→Cu+H2OCuO+H2→Cu+H2O
0,3 0,2 0,2
mrắn=mCu=0,2⋅64=12,8g.