Cho m gam hỗn hợp X gồm Cu, Fe vào dung dịch HCl dư, thu được 8,96 lít khí H 2 (đktc). Cũng cho m gam hỗn hợp X trên vào dung dịch H 2 S O 4 đặc, nóng dư, thoát ra 20,16 lít khí S O 2 (đktc). Giá trị của m là
A. 41,6
B. 54,4
C. 48,0
D. 46,4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : C
P1 : nH2 = nFe = 0,1 mol
P2 : Gọi số mol của Fe và Cu trong P2 lần lượt là x và y
=> bảo toàn e : 3x + 2y = 2nSO2 = 0,8 mol
, mmuối = mCuSO4 + mFe2(SO4)3 = 200x + 160y = 56g
=> x = 0,2 ; y = 0,1 mol
Tỉ lệ mol Fe : Cu trong các phần không đổi
=>Trong P1 : nCu = 0,05 mol
Trong m gam X có: 0,3 mol Fe và 0,15 mol Cu
=> m = 26,4g

Đáp án A
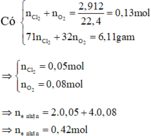
Y + HCl => Z chỉ chứa hai muối, HCl phản ứng hết
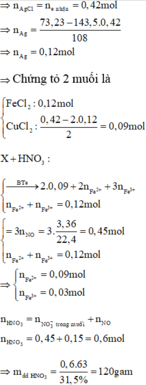
⇒ m dd T = 120 + 64 . 0 , 09 + 56 . 0 , 12 - 30 . 0 , 15 = 127 , 98 gam ⇒ C % Fe NO 3 3 = 242 . 0 , 03 127 , 98 . 100 % = 5 , 67 %
gần với giá trị 5% nhất

Chọn C
Phần 1 chỉ có Fe phản ứng → nFe = nH2 = 0,1
Phần 2 có cả Fe và Cu phản ứng, mà H2SO4 đặc dư → Fe lên Fe3+ hết
BTE → 3nFe + 2nCu = 2x 0,4 → nCu = (0,8 – 0,3)/2 = 0,25
Vậy 0,5m = 0,1 x 56 + 0,25 x 64 = 21,6 → m = 43,2.

Phần O2 sinh ra khi nung đi hết vào kim loại tạo oxit, đó là lý do ta chỉ thu được một khí Z là NO2 (0,4 mol).
Khi nung hỗn hợp T trong không khí thì sản phẩm thu được sẽ gồm các oxit “bão hòa” hóa trị (CuO, Fe2O3).
Số mol electron tối đa mà X có thể cho là: 3nNO =0,54 mol
Như vậy sẽ cần 0,54/2 = 0,27 mol O đưa vào rắn X để thu được 41,6 gam rắn gồm các oxit “bão hòa”.
→mX = mr + mO = 41,6 -0,27.16=37,28 gam
→m =mX = mNO2 = 37,28+46x0,4=55,68 gam
Chọn đáp án A

a, Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2}=\dfrac{7,28}{22,4}=0,35\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
a--------------------------------------->1,5a
Zn + H2SO4 ---> ZnSO4 + H2
b------------------------------>b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}27a+65b=10,55\\1,5a+b=0,35\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,15.27=4,05\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{4,05}{10,55}.100\%=38,4\%\\\%m_{Zn}=100\%-38,4\%=61,6\%\end{matrix}\right.\)
b, PTHH:
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1------------------------------>0,1----->0,1
\(2Al+3ZnSO_4\rightarrow Al_2\left(SO_4\right)_3+3Zn\downarrow\)
\(\dfrac{1}{15}\)<---0,1---------->\(\dfrac{1}{30}\)---------->0,1
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1----------------------------->0,1-------->0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\x=\dfrac{1}{30}.342+0,1.161=27,5\left(g\right)\end{matrix}\right.\)
\(a.Đặt:\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ \Rightarrow\left\{{}\begin{matrix}27x+65y=10,55\left(g\right)\\\dfrac{3}{2}x+y=\dfrac{7,28}{22,4}=0,325\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,15.27}{10,55}.100=38,39\%;\%m_{Zn}=61,61\%\\ b.X+H_2SO_4đặc,nguội\Rightarrow ChỉcóZnphảnứng\\ Zn\rightarrow Zn^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ Bảotoàne:n_{Zn}.2=n_{SO_2}.2\\ \Rightarrow n_{SO_2}=0,1\left(mol\right)\\ \Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\\ n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{ZnSO_4}=161.0,1=16,1\left(g\right)\)
Lưu ý: Al bị thụ động với H2SO4 dặc nguội
Chọn A