đốt cháy hoàn toàn hỗn hợp X gồm CH4 và H2 thu được 2,24 lít khí CO2 (đktc) và 6,3 g nước
a, viết PTHH
b, tính KL mỗi chất trong X
c, tính tỉ khối của X với H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có tổng cộng \(2\) \(PTHH\) sau:
\(1\)) \(CH4+2O2\overset{t^o}{\rightarrow}CO2+2H2O\)
\(2\)) \(2H2+O2\overset{t^o}{\rightarrow}2H2O\)
Có \(nCO2=\dfrac{2,24}{22,4}=0,1mol\)
Dựa vào \(PTHH1\)) \(nCO2=nCH4=0,1mol\)
Vậy \(mCH4=0,1.16=1,6g\)
Có \(nH2O=\dfrac{6,3}{18}=0,35mol\)
Ta thấy ở \(PTHH1\)) \(nH2O=2nCO2=0,1.2=0,2mol\)
Vậy số mol của \(H_2O\) ở \(PTHH2\) là \(0,35-0,2=0,15mol\)
Dựa vào \(PTHH2\)) \(nH2=nH2O=0,15mol\)
Vậy \(mH2=0,15.2=0,3g\)

Đáp án A
nX = 0,1 mol; nH2O = 0,35 mol
nX = nH2O - nCO2 => nCO2 = 0,35 - 0,1 = 0,25 mol
→ V = 22,4.0,25 = 5,6 lít

a)
2CO + O2 --to--> 2CO2
2H2 + O2 --to--> 2H2O
b) \(n_{H_2O}=\dfrac{12,6}{18}=0,7\left(mol\right)\); \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
0,6<--0,3<------0,6
2H2 + O2 --to--> 2H2O
0,7<--0,35<------0,7
=> \(\left\{{}\begin{matrix}V_{CO}=0,6.22,4=13,44\left(l\right)\\V_{H_2}=0,7.22,4=15,68\left(l\right)\end{matrix}\right.\)
VO2 = (0,3 + 0,35).22,4 = 14,56 (l)
c) \(M_A=\dfrac{0,6.28+0,7.2}{0,6+0,7}=14\left(g/mol\right)\)
=> \(d_{A/O_2}=\dfrac{14}{32}=0,4375\)

Câu 1 :
\(n_X=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(n_{CO_2}=\dfrac{12.32}{22.4}=0.55\left(mol\right)\)
\(\Rightarrow n_C=0.55\left(mol\right)\)
\(n_{H_2O}=\dfrac{10.8}{18}=0.6\left(mol\right)\)
\(\Rightarrow n_H=0.6\cdot2=1.2\left(mol\right)\)
\(m_X=m_C+m_H=0.55\cdot12+1.2=7.8\left(g\right)\)
\(\overline{M}_X=\dfrac{7.8}{0.15}=52\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{X}{H_2}}=\dfrac{52}{2}=26\)
Câu 2 :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Al}=\dfrac{a}{27}\left(mol\right)\)
\(n_{Fe}=\dfrac{a}{56}\left(mol\right)\)
Để cân thăng bằng thì lượng khí H2 thoát ra phải như nhau.
Vì :
\(n_{Fe}=\dfrac{a}{56}< n_{Al}=\dfrac{a}{27}\left(mol\right)\)
và lượng H2 sinh ra ở cả 2 phản ứng trên phụ thuộc vào HCl là như nhau
Để cân thăng bằng thì lượng HCl cho vào không vượt quá lượng tối đa để hòa tan Fe
\(n_{HCl}=2n_{Fe}=\dfrac{2a}{56}\left(mol\right)\)
\(\Rightarrow b\le\dfrac{2a}{56}\)

n CO 2 = 0,4mol
Thể tích của khí CO 2 : V CO 2 = 0,4 x 22,4 = 8,96l

Chọn C.
Đặt CTTQ của X là CxH4 Þ 12x + 4 = 28 Þ x = 2
Khi đốt cháy X thu được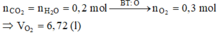
\(n_{CO_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(n_{H_2O}=\dfrac{6.3}{18}=0.35\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{^{^{t^0}}}CO_2+2H_2O\)
\(0.1..................0.1.......0.2\)
\(2H_2+O_2\underrightarrow{^{^{t^0}}}2H_2O\)
\(0.15........0.35-0.2\)
\(m_{CH_4}=0.1\cdot16=1.6\left(g\right)\)
\(m_{H_2}=0.15\cdot2=0.3\left(g\right)\)
\(\overline{M}_X=\dfrac{1.6+0.3}{0.1+0.15}=7.6\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{X}{H_2}}=\dfrac{7.6}{2}=3.8\)
sao số mol của H2O lại là 0,35-0,2 vậy bạn