Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

Ta có
\(\text{nHCl=0,2.0,1=0,02(mol)}\)
\(\text{nH2SO4=0,2.0,05=0,01(mol)}\)
2HCl+Ba(OH)2\(\rightarrow\)BaCl2+2H2O
H2SO4+Ba(OH)2\(\rightarrow\)BaSO4+2H2O
Ta có pH=13\(\rightarrow\)Ba(OH)2 dư
pH=13\(\rightarrow\)pOH=1\(\Rightarrow\)CM[OH-]=0,1(M)
\(\rightarrow\)CMBa(OH)2 dư=0,05(M)
\(\text{nBa(OH)2 dư=0,05.0,5=0,025(mol)}\)
\(\text{m=0,01.233=2,33(g)}\)
nBa(OH)2=0,025+0,02/2+0,01=0,045(mol)
\(\rightarrow\)a=\(\frac{0,045}{0,3}\)=0,15(M)

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 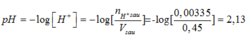
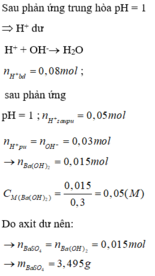
nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam