Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt 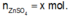
n Zn OH 2 TN 1 n Zn OH 2 TN 2 = m Zn OH 2 TN 1 m Zn OH 2 TN 2 = 3 a 2 a = 3 2 ⇒ n Zn OH 2 TN 1 = 3 y , n Zn OH 2 TN 2 = 2 y
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 Zn OH 2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
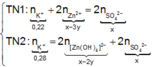
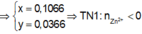 loại
loại
● Nếu ở TN1 Zn OH 2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
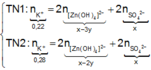
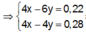
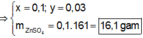

Đáp án B
Đặt
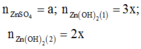
-Xét ở thí nghiệm 1
+ Nếu ![]() thì tạo thành kết tủa và kết tủa tan một phần
thì tạo thành kết tủa và kết tủa tan một phần
Và ở thí nghiệm 2 kết tủa cũng tan một phần
TN1: dung dịch sau phản ứng có ion:
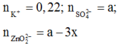
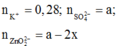
BTĐT:
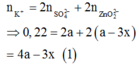
TN2: dung dịch sau phản ứng có ion:
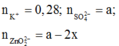
BTĐT:
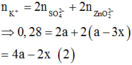
![]()
![]()
Với trường hợp ![]() thì không thỏa mãn
thì không thỏa mãn

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
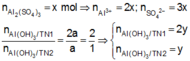
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
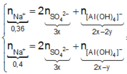
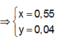
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
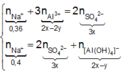
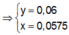
![]() (loại)
(loại)

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
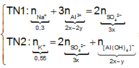
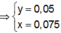
![]() thỏa mãn
thỏa mãn
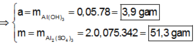
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
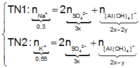
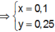
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

Đáp án C
Ta có:
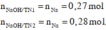
Theo giả thiết, suy ra : Ở TN2 kết tủa đã bị hòa tan một phần; ở TN1 kết tủa có thể đã bị hòa tan hoặc chưa.
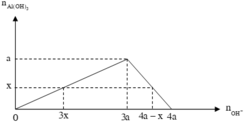
● Nếu ở TN1 kết tủa chưa bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:
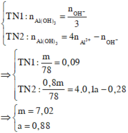
Suy ra : TN 1 : n Al ( OH ) 3 = 0 , 088 < n OH - 3 = 0 , 09 ( loại ) Vì như thế có nghĩa là đã có hiện tượng hòa tan kết tủa.
● Nếu ở TN1 kết tủa đã bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:


Đáp án B
Chọn số mol mỗi chất là 1 mol
A. Loại vì m 1 < m 2 < m 3
m 1 = + = 1.100 + 1.90 = 190 (g)
m 2 = + = 1.100 + 1.116 = 216 (g)
m 3 = mAgCl + mAg = 2.143,5 + 1.108 = 395 (g)
B. Chọn vì m 1 < m 3 < m 2
m 1 = = 90 (g) ; m 2 = = 116 (g) ; m 3 = mAg = 108 (g)
C. Loại vì m 3 > m 2 > m 1
m 1 = = 90 (g); m 2 = = 116 (g) ; m 3 = mAgCl + mAg = 3.143,5 + 1.108 = 538,5 (g)
D. Loại vì m 1 = m 2 > m 3
m 1 = = 197 (g); m 2 = = 197 (g); m 3 = mAgCl = 143,5 (g)

Đáp án C
n H C l = 0 , 2
Nếu cho 0,65 mol NaOH vào X thì thu được 2m gam kết tủa còn nếu thêm 0,925 mol NaOH thì thu được m gam kết tủa.
Chứng tỏ lúc cho 0,925 mol NaOH thì có sự hòa tan kết tủa.
Khi cho 0,65 mol NaOH tác dụng với X thì chỉ có 0,45 mol NaOH tác dụng với AlCl3 còn khi cho 0,925 mol thì có 0,725 mol tác dụng.
Nhận thấy 0,925-0,45>0,45 do vậy lúc cho 0,65 mol NaOH thì chưa hòa tan kết tủa.
→ n A l ( O H ) 3 = 0 , 15
Do vậy lúc cho 0,925 mol NaOH thì thu được 0,075 mol kết tủa.
→ n A l C l 3 = 0 , 725 - 0 , 075 . 3 4 + 0 , 075 = 0 , 2 m o l
→ a = 26 , 7 g a m


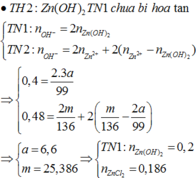
Đáp án B
Đặt
Từ giả thiết, suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Ở TN1 có thể kết tủa đã bị hòa tan hoặc chưa bị hòa tan.
Nếu ở TN1 Zn(OH)2 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
Từ (*) suy ra : TN1 đã có hiện tượng hòa tan kết tủa : Không thỏa mãn.
Vậy ở TN1 Zn(OH)2 đã bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :