Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
A. Nếu X, Y lần lượt là Al(NO3)3, Fe(NO3)2 thì thu được n1 = 2; n2 = 1; n3 = 1 .
B. Nếu X, Y lần lượt là MgCl2, Cu(NO3)2 thì thu được n1 = 1; n2 = 2; n3 = 2. (thoả mãn).
C. Nếu X, Y lần lượt là NaCl, FeCl2 thì thu được n1 = 1; n2 = 1; n3 = 4.
D. Nếu X, Y lần lượt là FeCl3, NaCl thì thu được n1 = 1; n2 = 1; n3 = 4.

Đáp án B
Xét thí nghiệm 1 và 2 có tạo số mol kết tủa bằng nhau
=> 2 chất X và Y không thể là A l 3 + v à F e 2 + vì A l ( O H ) 3 tan trong NaOH và không tan trong N H 3
Do đó số kết tủa ở thí nghiệm 1 sẽ phải nhỏ hơn thí nghiệm 2 => không thỏa mãn đề bài

Đáp án C
Giả sử số mol mỗi chất X, Y là 1 mol.
- Phương án A:
TN1: Kết tủa gồm F e ( O H ) 2 (1 mol) => x 1 = 1
TN2: Kết tủa gồm B a C O 3 (1 mol) và F e C O 3 (1 mol) => x 2 = 2
TN3: Kết tủa gồm F e ( O H ) 2 (1 mol) => x 3 = 1
=> Không thỏa mãn x 1 < x 2 < x 3
- Phương án B:
TN1: Kết tủa gồm 1 mol A l ( O H ) 3 và 1 mol F e ( O H ) 3 => x 1 = 2
TN2: Kết tủa gồm 1 mol A l ( O H ) 3 (do A l 2 ( C O 3 ) 3 phân hủy thành) và 1 mol F e ( O H ) 3 (do F e 2 ( C O 3 ) 3 phân hủy thành) => x 2 = 2
TN3: Kết tủa gồm 1 mol F e ( O H ) 3 => x 3 = 1
=> Không thỏa mãn x 1 < x 2 < x 3
- Phương án C:
TN1: Kết tủa gồm 2 mol A l ( O H ) 3 (chú ý Z n ( O H ) 2 tạo phức với N H 3 nên bị tan) => x 1 = 2
TN2: Kết tủa gồm 1 mol Z n C O 3 (1 mol) và 2 mol A l ( O H ) 3 (do A l 2 ( C O 3 ) 3 phân hủy thành) => x 2 = 3
TN3: Kết tủa gồm 4 mol B a S O 4 => x 3 = 4
=> Thỏa mãn x 1 < x 2 < x 3
- Phương án D:
TN1: Kết tủa gồm 1 mol F e ( O H ) 2 và 2 mol F e ( O H ) 3 => x 1 = 3
TN2: Kết tủa gồm 1 mol F e C O 3 và 2 mol F e ( O H ) 3 (do F e 2 ( C O 3 ) 3 phân hủy thành) => x 2 = 3
TN3: Kết tủa gồm 1 mol F e ( O H ) 2 ; 2 mol F e ( O H ) 3 và 4 mol B a S O 4 => x 3 = 7 mol
=> Không thỏa mãn x 1 < x 2 < x 3

Chọn D.
Nếu X, Y lần lượt là BaCl2 và FeCl2 thì: x1 = 1 ; x2 = 2 ; x3 = 1
Nếu X, Y lần lượt là FeSO4 và Fe2(SO4)3 thì: x1 = 3 ; x2 = 3 ; x3 = 7
Nếu X, Y lần lượt là AlCl3 và FeCl3 thì: x1 = 2 ; x2 = 2 ; x3 = 1
Nếu X, Y lần lượt là ZnSO4 và Al2(SO4)3 thì: x1 = 2 ; x2 = 3 ; x3 = 4 (thoả mãn).

Chọn D.
Loại A vì dung dịch Z tác dụng với H+ không sinh ra kết tủa.
+ Nếu X là Ba, Y là Zn Þ Z chứa Ba2+: a mol và ZnO22-: a mol Þ n2 > n1 (Loại)
+ Nếu X là Ba, Y là Al Þ Z chứa Ba2+: a mol ; AlO2-: a mol ; OH- dư: a mol Þ n2 > n1 (Loại)
+ Nếu X là Na, Y là Al Þ Z chứa Na+: a mol ; AlO2-: a mol Þ n2 < n3 < n1 (Thoả)

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
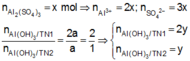
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
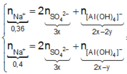
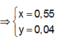
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
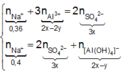
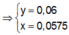
![]() (loại)
(loại)

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
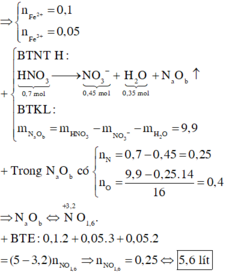
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
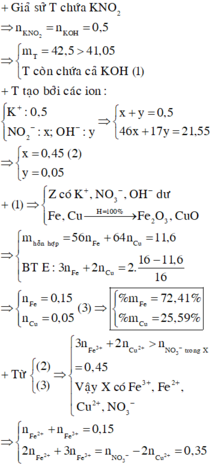
Đáp án B
Chọn số mol mỗi chất là 1 mol
A. Loại vì m 1 < m 2 < m 3
m 1 = + = 1.100 + 1.90 = 190 (g)
m 2 = + = 1.100 + 1.116 = 216 (g)
m 3 = mAgCl + mAg = 2.143,5 + 1.108 = 395 (g)
B. Chọn vì m 1 < m 3 < m 2
m 1 = = 90 (g) ; m 2 = = 116 (g) ; m 3 = mAg = 108 (g)
C. Loại vì m 3 > m 2 > m 1
m 1 = = 90 (g); m 2 = = 116 (g) ; m 3 = mAgCl + mAg = 3.143,5 + 1.108 = 538,5 (g)
D. Loại vì m 1 = m 2 > m 3
m 1 = = 197 (g); m 2 = = 197 (g); m 3 = mAgCl = 143,5 (g)