Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
n H C l = 0 , 2 m o l
Nếu cho 0,65 mol NaOH vào X thì thu được 2m gam kết tủa còn nếu thêm 0,925 mol NaOH thì thu được m gam kết tủa. Chứng tỏ lúc cho 0,925 mol NaOH thì có sự hòa tan kết tủa.
Khi cho 0,65 mol NaOH tác dụng với X thì chỉ có 0,45 mol NaOH tác dụng với AlCl3 còn khi cho 0,925 mol thì có 0,725 mol tác dụng.
Nhận thấy 0,925-0,45>0,45 do vậy lúc cho 0,65 mol NaOH thì chưa hòa tan kết tủa.
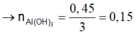
Do vậy lúc cho 0,925 mol NaOH thì thu được 0,075 mol kết tủa.
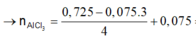
= 0,2 mol
=> a = 26,7 gam

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
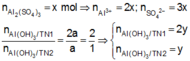
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
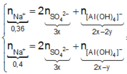
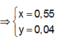
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
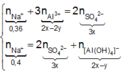
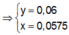
![]() (loại)
(loại)

Đáp án C
nNaOH = 0,33 (mol) ; nAlCl3 = 0,1 (mol)
Ta có: 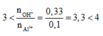
=> Tạo cả Al(OH)3 và AlO2-
Áp dụng công thức nhanh
nAl(OH)3 = 4nAl3+ - nOH- = 4.0,1 – 0,33 =0,07 (mol)
=> mAl(OH)3↓ = 0,07.78 = 5,46 (g)

Giải thích:
nNaOH = 0,33 (mol) ; nAlCl3 = 0,1 (mol)
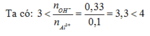
=> Tạo cả Al(OH)3 và AlO2-
Áp dụng công thức nhanh
nAl(OH)3 = 4nAl3+ - nOH- = 4.0,1 – 0,33 =0,07 (mol)
=> mAl(OH)3↓ = 0,07.78 = 5,46 (g)
Đáp án C

Đáp án C
nNaOH = 0,33 (mol) ; nAlCl3 = 0,1 (mol)
Ta có:
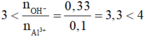
=> Tạo cả Al(OH)3 và AlO2-
Áp dụng công thức nhanh
nAl(OH)3 = 4nAl3+ - nOH- = 4.0,1 – 0,33 =0,07 (mol)
=> mAl(OH)3↓ = 0,07.78 = 5,46 (g)

Đáp án D
Có n(NaOH) = 0,15 mol; n(H2) = 0,08 mol.
Dd X gồm Na+; ZnO2-, OH‑.
OH- + H+ → H2O
ZnO2- + 2H+ → Zn(OH)2 ↓
Zn(OH)2 + 2H+ → Zn2+ + H2O.
Dùng hết 0,08 mol HCl thì bắt đầu có kết tủa → n(OH-) = 0,08 mol.
Khi cho 0,32 mol HCl hay 0,48 mol HCl vào dd X đều thu được a gam kết tủa.
Có:
n(H+ trước) = 2.n↓ + n(OH-) → n↓ = (0,32 – 0,08) : 2 = 0,12 mol.
n(H+ sau) = 4.n(ZnO2-) – 2n↓ + n(OH-) → n(ZnO2-) = 0,16 mol.
BTĐT trong dd X → n(Na+) = 0,4 mol.
BTNT (H): n(NaOH) + 2n(H2O) = 2.n(H2) + n(OH-)
→ n(H2O) = (2.0,08 + 0,08) : 2 = 0,045 mol.
BTKL: m(hh) + m(NaOH) + m(H2O) = m(H2) + m(Na+) + m(ZnO2-) + m(OH-)
→ m = (0,08.2 + 23.0,4 + 0,16.97 + 0,08.17) – (0,15.40 + 0,045.18) = 19,43 gam.

Đáp án D
nAl = 0,02 mol; nCl– = 0,07 mol; nNa+ = 0,075 mol.
Ghép NaCl
⇒ còn dư (0,075 – 0,07 = 0,005) mol Na+
⇒ ghép với AlO2– tạo NaAlO2.
||⇒ ghép được 0,005 mol NaAlO2 và còn dư (0,02 – 0,005 = 0,015) mol nguyên tố Al.
► Dùng nguyên tố đó ghép vào ↓ ⇒ nAl(OH)3 = 0,015 mol
⇒ m = 1,17(g)

Giải thích:
nAl = 0,02 mol
nHCl = 0,07 mol
nNaOH = 0,075 mol
Al + 3HCl → AlCl3 + 1,5H2
Bđ: 0,02 0,07
Pư: 0,02 0,06 0,02
Sau: 0 0,01 0,02
Vậy dung dịch X gồm: Al3+ (0,02 mol) và H+ dư (0,01 mol)
Khi cho 0,075 mol NaOH vào dd X:
H+ + OH- → H2O
0,01 0,01
Al3+ + 3OH- → Al(OH)3
0,02 0,06 0,02
Al(OH)3 + OH- → AlO2- + 2H2O
0,005←0,005
Vậy khối lượng Al(OH)3: m = (0,02-0,005).78 = 1,17 gam
Đáp án B
Đáp án C
n H C l = 0 , 2
Nếu cho 0,65 mol NaOH vào X thì thu được 2m gam kết tủa còn nếu thêm 0,925 mol NaOH thì thu được m gam kết tủa.
Chứng tỏ lúc cho 0,925 mol NaOH thì có sự hòa tan kết tủa.
Khi cho 0,65 mol NaOH tác dụng với X thì chỉ có 0,45 mol NaOH tác dụng với AlCl3 còn khi cho 0,925 mol thì có 0,725 mol tác dụng.
Nhận thấy 0,925-0,45>0,45 do vậy lúc cho 0,65 mol NaOH thì chưa hòa tan kết tủa.
→ n A l ( O H ) 3 = 0 , 15
Do vậy lúc cho 0,925 mol NaOH thì thu được 0,075 mol kết tủa.
→ n A l C l 3 = 0 , 725 - 0 , 075 . 3 4 + 0 , 075 = 0 , 2 m o l
→ a = 26 , 7 g a m