Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride được giải thích như sau:
+ Khối lượng phân tử HBr (81) cao hơn khối lượng phân tử HCl (36,5)
+ Br có bán kính nguyên tử lớn, có nhiều electron hơn Cl => Tăng khả năng lưỡng cực HX => Làm tăng tương tác van der Waals giữa các phân tử

- Khi cho từ từ vài giọt dung dịch silver nitrate vào ống nghiệm chứa từng dung dịch potassium fluoride, hydrochloric acid, sodium bromide:
+ Ống nghiệm xuất hiện kết tủa trắng AgCl => Ống nghiệm đó chứa HCl
HCl + AgNO3 → AgCl↓ + HNO3
+ Ống nghiệm xuất hiện kết tủa vàng nhạt AgBr => Ống nghiệm đó chứa NaBr
NaBr + AgNO3 → AgBr↓ + NaNO3
+ Ống nghiệm không có sự biến đổi do không có phản ứng hóa học xảy ra => Ống nghiệm chứa KF

- Thí nghiệm 1:
+ Khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu thì tạo ra dung dịch màu vàng nâu của bromine:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
+ Khi nhỏ 2 mL cyclohexane vào ống nghiệm, quan sát thấy màu vàng nâu của bromine nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
- Thí nghiệm 2:
+ Khi cho nước bromine màu vàng vào dung dịch sodium iodine không màu thì tạo ra dung dịch màu vàng:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(aq)
+ Khi cho thêm 2 mL cyclohexane thấy màu dung dịch nhạt dần do bromine tham gia phản ứng với cyclohexane:
Br2 + C6H12 → HBr + C6H11Br
+ Khi thêm tiếp vài giọt hồ tinh bột thì thấy dung dịch từ màu vàng chuyển sang màu xanh tím do iodine tác dụng với hồ tinh bột

- Xét phản ứng của NaCl với H2SO4:
NaCl(s) + H2SO4(l) \(\xrightarrow{{{t^o}}}\) NaHSO4(s) + HCl(g)
=> Ion Cl- không thể hiện tính khử, không có sự thay đổi số oxi hóa
=> Không phải phản ứng oxi hóa – khử
- Xét phản ứng của NaI với H2SO4:
8NaI(s) + 9H2SO4(l) → 8NaHSO4(s) + I2(g) + H2S(g) + 4H2O(g)
=> Ion I- thể hiện tính khử và khử sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa -2 trong H2S
- Giải thích: Do ion Cl- có tính khử yếu hơn ion I-

Người ta có thể điều chế Cl 2 , Br 2 , I 2 bằng cách cho hỗn hợp dung dịch H 2 SO 4 đặc và MnO 2 tác dụng với muối clorua, bromua, iotua
Các sản phẩm trung gian là HCl, HBr, HI bị hỗn hợp ( MnO 2 + H 2 SO 4 ) oxi hoá thành Cl 2 , Br 2 , I 2 . Các PTHH có thể viết như sau :
NaCl + H 2 SO 4 → Na HSO 4 + HCl
MnO 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế F 2 vì hỗn hợp oxi hoá ( MnO 2 + H 2 SO 4 ) không đủ mạnh để oxi hoá HF thành F 2
Cách duy nhất điều chế F 2 là điện phân KF tan trong HF lỏng khan Dùng dòng điện một chiểu 8-12 von ; 4000 - 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catot: 2 H + + 2 e → H 2
Ở anot: 2 F - → F 2 + 2 e

Điều chế HF, HCl bằng cách cho H 2 SO 4 đặc tác dụng với muối florua, clorua vì H 2 SO 4 à chất oxi hoá không đủ mạnh để oxi hoá được HF và HCl. Nói cách khác, HF và HCl có tính khử yếu, chúng không khử được H 2 SO 4 đặc
Ca F 2 + H 2 SO 4 → Ca SO 4 + 2HF
NaCl + H 2 SO 4 → NaH SO 4 + HCl
Nhưng không thể dùng phương pháp trên để điều chế HBr và HI vì H 2 SO 4 đặc oxi hoá được những chất này thành Br 2 và I 2 . Nói cách khác, HBr và HI là những chất có tính khử mạnh hơn HCl và HF.
NaBr + H 2 SO 4 → HBr + NaH SO 4
2HBr + H 2 SO 4 → Br 2 + SO 2 + 2 H 2 O
NaI + H 2 SO 4 → NaH SO 4 + HI
2HI + H 2 SO 4 → I 2 + SO 2 + 2 H 2 O

Do tính khử HBr, HI lớn, nó sẽ tác dụng với H2SO4 đặc nóng sinh ra Br2, I2 nên không thể điều chế HBr và HI theo phương pháp sunfat.

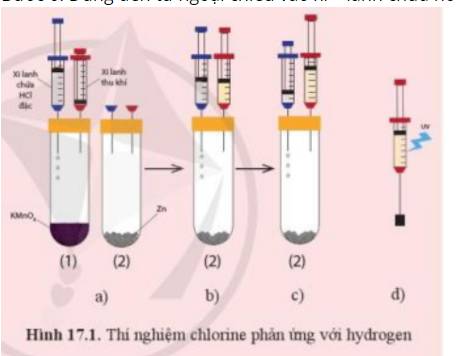
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI

NaBr sẽ khử axit sunfuric đặc thành sunfua đioxit
NaI sẽ khử axit sunfuric đặc thành hydrogen sunfít
- Khi potassium bromide phản ứng với sulfuric acid đặc, đun nóng. Ta có phương trình:
2NaBr(s) + 3H2SO4(l) \(\xrightarrow{{{t^o}}}\) 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
=> Sản phẩm tạo thành không có HBr
=> Không thể điều chế hydrogen bromide từ phản ứng giữa potassium bromide với sulfuric acid đặc