Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Chất rắn A gồm Fe dư và FeS.
Theo PT: \(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Fe\left(dư\right)}=0,2\left(mol\right)\\n_{H_2S}=n_{FeS}=0,1\left(mol\right)\end{matrix}\right.\)
Ở cùng điều kiện nhiệt độ và áp suất, %V cũng là % số mol.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,2+0,1}.100\%\approx66,67\%\\\%V_{H_2S}\approx33,33\%\end{matrix}\right.\)
b, Ta có: \(\Sigma n_{HCl\left(dadung\right)}=2n_{Fe}+2n_{FeS}=0,6\left(mol\right)\) (1)
PT: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=0,1.2=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(dư\right)}=n_{NaOH}=0,2\left(mol\right)\) (2)
Từ (1) và (2) \(\Rightarrow\Sigma n_{HCl}=0,8\left(mol\right)\)
\(\Rightarrow C_{M_{ddHCl}}=\dfrac{0,8}{0,5}=1,6\left(M\right)\)
Bạn tham khảo nhé!

a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{HCl}=2n_{Fe}=0,5\left(mol\right)\\n_{H_2}=n_{Fe}=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
\(a=C_{M_{HCl}}=\dfrac{0,5}{0,1}=5\left(M\right)\)
b, Theo PT: \(n_{FeCl_2}=n_{Fe}=0,25\left(mol\right)\)
Ta có: \(n_{AgNO_3}=0,4.1,3=0,52\left(mol\right)\)
PT: \(2AgNO_3+FeCl_2\rightarrow Fe\left(NO_3\right)_2+2AgCl_{\downarrow}\)
______0,5______0,25______0,25________0,5 (mol)
\(AgNO_3+Fe\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_3+Ag_{\downarrow}\)
0,02______0,02________0,02________0,02 (mol)
⇒ m = mAgCl + mAg = 0,5.143,5 + 0,02.108 = 73,91 (g)
- Dd sau pư gồm: Fe(NO3)3: 0,02 (mol) và Fe(NO3)2: 0,25 - 0,02 = 0,23 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe\left(NO_3\right)_3}}=\dfrac{0,02}{0,1+0,4}=0,04\left(M\right)\\C_{M_{Fe\left(NO_3\right)_2}}=\dfrac{0,23}{0,1+0,4}=0,46\left(M\right)\end{matrix}\right.\)
\(Fe+2HCl->FeCl_2+H_2\\ a.V=\dfrac{14}{56}\cdot22,4=5,6\left(L\right)\\ a=\dfrac{\dfrac{14}{56}\cdot2}{0,1}=5\left(M\right)\\ b.n_{AgNO_3}=0,4\cdot1,3=0,52mol\\ FeCl_2+AgNO_3->Fe\left(NO_3\right)_2+AgCl\\ Fe\left(NO_3\right)_2+AgNO_3->Ag+Fe\left(NO_3\right)_3\\ m=0,25\cdot143,5+0,25\cdot108=62,875\left(g\right)\\ C_{M\left(AgNO_3\right)}=\dfrac{0,02}{0,5}=0,04M\\ C_{M\left(Fe\left(NO_3\right)_3\right)}=\dfrac{0,25}{0,5}=0,5M\)

a) chất rắn ko tan là Cu. => m Cu= 0,64g.
=> m ( Al + Fe) = 1,46 - 0,64 = 0,82 g
ta có pt: 27x+56y=0,82 (1) ( với x: số mol Al; y : số mol Fe)
PTHH 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
x -----------------> x/2 ----> 3/2 .x
Fe + H2SO4 = FeSO4 + H2
y ----------- > y ------> y
số mol H2 = 3/2 x +y = 0,035 (2)
giải 1 và 2 đc x= 0,02 y= 0,005
%m Al = 36,98% % m Fe= 19,18% %m Cu = 43,84%
b) số mol NaOH= 0,15
số mol H2SO4 phản ứng = số mol H2 = 0,035
nồng độ của h2so4 = 0,035/ 0,2= 0,175M
PTHH Al2(SO4)3 +6NaOH = 2Al(OH)3 + 3Na2SO4
0,02/2 -------> 0,06 ----> 0,02 ------> 0,03
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
0,005 ---> 0,01----------------> 0,005
số mol NaOH phản ứng= 0,07 < số mol đề bài = 0,15
số mol NaOH dư= 0,08
NaOH dư + Al(OH)3 = NaAlO2 + 2H20
0,02 <-------0,02 --------> 0,02
DD B gồm NaOH dư ( 0,06 mol); NaAlO2 ; Na2SO4
Cm của Na2SO4 = 0,035/ 0,3 = 0,12M
Cm của NaALO2 = 0,02/0,3 = 0,06M
Cm của NaOH dư = 0,06/0,3 = 0,2M

a)Gọi x,y lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu (x,y>0)
Sau phản ứng hỗn hợp muối khan gồm: \(\left\{{}\begin{matrix}AlCl_3:x\left(mol\right)\\FeCl_2:y\left(mol\right)\end{matrix}\right.\)
Ta có hệ phương trình: \(\left\{{}\begin{matrix}27x+56y=13,9\\133,5x+127y=38\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x\approx0,0896\\y\approx0,205\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,0896\cdot27\cdot100\%}{13,9}\approx17,4\%\\\%m_{Fe}=\dfrac{0,205\cdot56\cdot100\%}{13,9}\approx82,6\%\end{matrix}\right.\)
Theo Bảo toàn nguyên tố Cl, H ta có:\(n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{3n_{AlCl_3}+2n_{FeCl_2}}{2}\\ =\dfrac{3\cdot0,0896+2\cdot0,205}{2}=0,3394mol\\ \Rightarrow V_{H_2}=0,3394\cdot22,4\approx7,6l\)
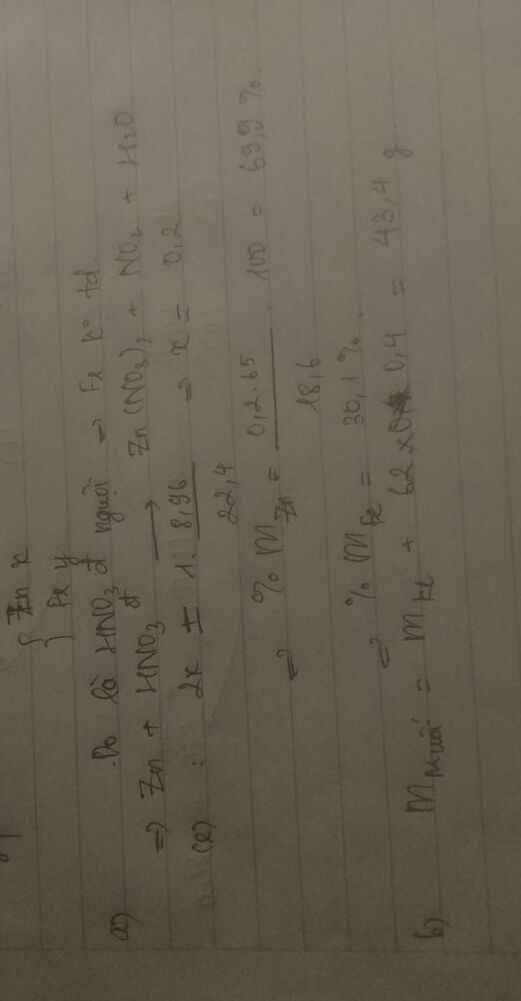

Có lẽ đề yêu cầu tính nồng độ mol các chất trong dung dịch sau pư bạn nhỉ?
PTHH: ZnO + 2HCl -> ZnCl\(2 \) + H\(2 \)O
Zn + 2HCl -> ZnCl\(2 \) + H\(2 \)
nH2= V/22.4= 0.224/22.4=0.01 mol
Mà nZn=nH2 => nZn=0.01 mol
mZn=n.M= 0.01 x 65 = 0,65g
mZnO= 1.46-0.65=0.81g => nZnO= m/M= 0.81/81=0.01 mol
nddHCl=V.CM=0.1 x 0.5= 0.05 mol
Theo pt ta thấy: nHCl= 0.01 x 2 + 2x0.01= 0.04 mol
nHCl dư= 0.05-0.04=0.01 mol
=> CM HCl dư= 0.01/0.1= 0.1M
CM ZnCl2= 0.01+0.01/0.1=0.2M