Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
- Khi nung hỗn hợp X thì:

=0,05 mol
- Khi cho hỗn hợp X tác dụng với HCl thì:
![]()
- Khi cho dung dịch Y tác dụng với dung dịch AgNO3 dư thì:
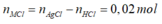
![]()
=> 0,1(2M+60)+0,05(M+61)+0,02(M+35,5) =20,29
=> M = 39. Vậy M là K

Đáp án D
Đặt nNO = x; nN2O = y ⇒ nZ = x + y = 0,005 mol; mZ = 30x + 44y = 0,005 × 19,2 × 2.
||⇒ giải hệ có: x = 0,002 mol; y = 0,003 mol || nMg dư = nH2 = 0,005 mol
⇒ nAg = (0,336 – 0,005 × 24) ÷ 108 = 0,002 mol. Đặt nMg phản ứng = a. Bảo toàn electron:
2nMg phản ứng = 3nNO + 8nN2O + 8nNH4NO3 + nAg ⇒ nNH4NO3 = (0,25a – 0,004) mol
||⇒ mmuối = 148a + 80.(0,25a – 0,004) = 3,04(g) ⇒ a = 0,02 mol. Lại có:
ne = nH+ = nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol ⇒ t = 2316(s)

Đáp án D
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
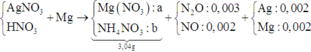
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,048 mol.
⇒ t = 0,048 × 96500 ÷ 2 = 2316s



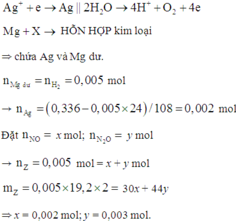
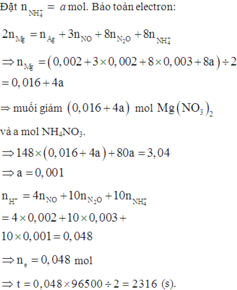
\(n_{H_2}=\dfrac{13.44}{22.4}=0.6\left(mol\right)\)
\(n_{M\left(pu\right)}=a\left(mol\right)\)
Bảo toàn e :
\(na=0.15\cdot4+0.6\cdot2=1.8\)
\(a=\dfrac{1.8}{n}\)
\(M=\dfrac{16.2}{\dfrac{1.8}{n}}=9n\)
\(n=3\Rightarrow M=27.M:Al\)
Bảo toàn e toàn bộ quá trình ta có: $n_{M}=\frac{1,8}{n}(mol)$
$\Rightarrow M_{M}=9n$
Lập bảng biện luận suy ra M là Al