Dùng 500ml dung dịch H2SO4 1M để hòa tan hết x g kim loại sắt. a) Viết PTHH của phản ứng b) Tính khối lượng Fe (x) đã phản ứng c) Tính nồng độ mol của dung dịch sắt (||) sunfat sau phản ứng? ( Cho rằng thể tích dung dịch không thay đổi)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Fe + H2SO4 --> FeSO4 + H2
b)
\(n_{H_2SO_4}=0,3.0,6=0,18\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,18<--0,18---->0,18-->0,18
=> \(m_{FeSO_4}=0,18.152=27,36\left(g\right)\)
c) VH2 = 0,18.22,4 = 4,032 (l)

a) PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{H_2SO_4}=C_MV=1,2\cdot0,5=0,6\left(mol\right)\)
PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,6 0,6 0,6
\(\Rightarrow m_{FeSO_4}=n_{FeSO_4}M_{FeSO_4}=0,6\cdot152=91,2\left(g\right)\)
c) Từ câu b \(\Rightarrow n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,6\cdot22,4=13,44\left(l\right)\)
d) PTHH : \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6
\(\Rightarrow m_{Cu}=n_{Cu}M_{Cu}=0,6\cdot64=38,4\left(g\right)\)
a)\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
b)Đổi 500ml = 0,5l
Số mol của H2SO4 là:
\(C_{MH_2SO_4}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_{\text{4 }}}}\Rightarrow n_{H_2SO_4}=C_{MH_2SO_4}.V_{H_2SO_4}=1,2.0,5=0,6\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
Tỉ lệ : 1 1 1 1 (mol)
Số mol : 0,6 0,6 0,6 0,6(mol)
Khối lượng sắt(II)sunfat thu được là:
\(m_{FeSO_4}=n_{FeSO_4}.M_{FeSO_{\text{4 }}}=0,6.152=91,2\left(g\right)\)
c) Thể tích khí H2 thoát ra là:
\(V_{H_2}=n_{H_2}.22,4=0,6.22,4=13,44\left(l\right)\)
d)\(PTHH:CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\)
tỉ lệ :1 1 1 1 (mol)
số mol :0,6 0,6 0,6 0,6 (mol)
Khối lượng CuO điều chế được là:
\(m_{CuO}=n_{CuO}.M_{CuO}=0,6.80=48\left(g\right)\)

\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,3-->0,3----------->0,3
=> \(\left\{{}\begin{matrix}C_{M\left(H_2SO_4\right)}=\dfrac{0,3}{0,15}=2M\\m_{muối}=0,3.152=45,6\left(g\right)\end{matrix}\right.\)

\(n_{H_2}=\dfrac{4,958}{24,79}=0,2mol\\ a)Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ b)n_{Fe}=n_{FeSO_4}=n_{H_2}=0,2mol\\ m_{Fe}=0,2.56=11,2g\\ c)m_{ddFeSO_4}=11,2+200-0,2.2=210,8g\\ m_{FeSO_4}=0,2.152=30,4g\\ C_{\%_{FeSO_4}}=\dfrac{30,4}{210,8}\cdot100\%=14,42\%\)
a) Viết phương trình hóa học và cân bằng:
\( \mathrm{Fe} + \mathrm{H}_2\mathrm{SO}_4 \rightarrow \mathrm{FeSO}_4 + \mathrm{H}_2 \)
b) Để tính khối lượng sắt đã phản ứng, ta cần biết số mol của khí hydrogen đã thoát ra. Với điều kiện đo ở đkc, 1 mol khí hydrogen có thể chiếm 22.4 L. Vì vậy, số mol khí hydrogen thoát ra là:
\( \text{Số mol } \mathrm{H}_2 = \dfrac{4.958}{22.4} \)
Theo phương trình cân bằng, ta biết rằng 1 mol sắt phản ứng với 1 mol khí hydrogen. Vì vậy, số mol sắt đã phản ứng cũng bằng số mol khí hydrogen:
\( \text{Số mol sắt} = \dfrac{4.958}{22.4} \)
Để tính khối lượng sắt đã phản ứng, ta sử dụng khối lượng mol của sắt:
\( \text{Khối lượng sắt} = \text{Số mol sắt} \times \text{Khối lượng mol sắt} \)
c) Để tính nồng độ phần trăm của dung dịch muối thu được, ta cần biết khối lượng muối thu được và khối lượng dung dịch ban đầu.
Khối lượng muối thu được là khối lượng của muối \( \mathrm{FeSO}_4 \), và khối lượng dung dịch ban đầu là khối lượng của dung dịch \( \mathrm{H}_2\mathrm{SO}_4 \).
Nồng độ phần trăm của dung dịch muối thu được được tính bằng công thức:
\( \text{Nồng độ phần trăm} = \dfrac{\text{Khối lượng muối thu được}}{\text{Khối lượng dung dịch ban đầu}} \times 100\)
Với các giá trị đã tính được ở bước trước, ta có thể tính nồng độ phần trăm của dung dịch muối thu được.

Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,4 0,2 0,2
a) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl= nHCl . MHCl
= 0,4 . 36,5
= 14,6 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
b) Số mol của muối sắt (II) clorua
nFeCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2= nFeCl2 . MFeCl2
= 0,2 . 127
= 25,4 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 200 - ( 0,2 .2)
= 210,8 (g)
c) Nồng độ phần trăm của muối sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{25,4.100}{210,8}=12,05\)0/0
d) Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.300}{100}=21,9\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,6 0,3 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe
Sau phản ứng thu được muối FeCl2 và dung dịch HCl còn dư
Số mol của sắt (II) clorua
nFeCl2 = \(\dfrac{0,6.1}{2}=0,3\left(mol\right)\)
Khối lượng của sắt (II) clorua
mFeCl2 = nFeCl2 . MFeCl2
= 0,3 . 127
= 38,1 (g)
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,6 - (0,2 . 2)
= 0,2 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư. MHCl
= 0,2 . 36,5
= 7,3 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mFe + mHCl - mH2
= 11,2 + 300 - (0,3 . 2)
= 310,6 (g)
Nồng độ phần trăm của sắt (II) clorua
C0/0FeCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{38,1.100}{310,6}=12,27\)0/0
Nồng độ phần trăm của dung dịch axit clohdric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{7,3.100}{310,6}=2,35\)0/0
Chúc bạn học tốt

\(Fe+H_2SO_4 \to FeSO_4+H_2\\ n_{H_2}=0,15(mol)\\ a/\\ n_{Fe}=n_{H_2}=0,15(mol)\\ m_{Fe}=0,15.56=8,4(g)\\ b/\\ n_{H_2SO_4}=n_{H_2}=0,15(mol)\\ CM_{H_2SO_4}=\dfrac{0,15}{2}=0,75M c/\\ n_{FeSO_4}=n_{H_2}=0,15(mol)\\ CM_{FeSO_4}=\dfrac{0,15}{0,2}=0,75M\\\)
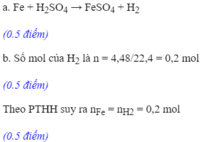

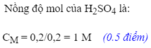
\(n_{H_2SO_4}=0.5\cdot1=0.5\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.5......0.5.............0.5\)
\(m_{Fe}=0.5\cdot56=28\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.5}{0.5}=1\left(M\right)\)
Bạn có thể làm rõ ý c hộ mình được không ạ?