X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.
Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong hợp chất tạo thành từ X và Y là
A. 2 s 2 2 p 5 , 4 s 1 và liên kết cộng hóa trị.
B. 2 s 2 2 p 3 , 3 s 2 3 p 1 và liên kết cộng hóa trị.
C. 3 s 2 3 p 5 , 4 s 1 và liên kết ion.
D. 2 s 2 2 p 5 , 4 s 1 và liên kết ion.



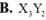

Chọn D
Cấu hình electron nguyên tử X: [He]2s22p5.
Cấu hình electron nguyên tử Y: [Ar]4s1
X là phi kim điển hình (nhóm VIIA) và Y là kim loại điển hình (nhóm IA) nên liên kết trong hợp chất tạo thành từ X và Y là liên kết ion.