Xét phản ứng : 2 N O 2 ( k ) ⇄ N 2 O 4 ( k ) . Tỉ khối hơi của hỗn hợp khí thu được so với H 2 ở nhiệt độ t 1 là 27,6 ; ở nhiệt độ t 2 là 34,5 t 1 > t 2 . Có 3 ống nghiệm đựng khí N O 2 (có nút kín). Sau đó : Ngâm ống thứ nhất vào cốc nước đá ; ngâm ống thứ hai vào cốc nước sôi ; ống thứ ba để ở điều kiện thường. Một thời gian sau, ta thấy
A. ống thứ nhất có màu đậm nhất, ống thứ hai có màu nhạt nhất
B. ống thứ nhất có màu nhạt nhất, ống thứ hai có màu đậm nhất
C. ống thứ nhất có màu đậm nhất, ống thứ ba có màu nhạt nhất
D. ống thứ nhất có màu đậm nhất, ống thứ hai và ống thứ ba đều có màu nhạt hơn


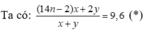

Chọn B
Ở nhiệt độ t 2 hỗn hợp khí có tỉ khối hơi so với H 2 lớn hơn nhiệt độ t 1 → ở nhiệt độ t 2 có lượng N 2 O 4 lớn hơn ở nhiệt độ t 1 .
Mà t 1 > t 2 → khi giảm nhiệt độ cân bằng chuyển dịch theo chiều thuận (tạo thành N 2 O 4 không màu); khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch (tạo thành N O 2 màu nâu).