Trong phòng thí nghiệm có các kim loại kẽm và sắt, dung dịch axit clohiđric HCl và axit sunfuric H\(_2\)SO\(_4\) loãng:
a. Viết phương trình hóa học có thể điều chế hi đro;
b. Phải dùng bao nhiêu gam kẽm, bao nhiêu gam sắt để diều chế được 2,24 lít khí hiđro (ở đktc)?

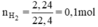
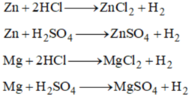
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
b. Ta có
nH2 = \(\dfrac{2,24}{22,4}\) = 0,1 (mol)
mzn = 0,1 . 65 = 6,5 ( gam )
mFe = 0,1 . 56 = 5,6 ( gam ).
a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2 ↑
Fe + H2SO4 (loãng) → FeSO4 + H2 ↑
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
b. Số mol khí hiđro là: n = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).