Trong nguyên tử, những electron của lớp nào quyết định tính chất hoá học của nguyên tử nguyên tố đó ? Cho thí dụ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hóa học của nguyên tử nguyên tố.
Thí dụ: Liti, natri có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại, oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.

Đối với các nguyên tố thuộc các nhóm A thì những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tố tương ứng.
Các electron ở lớp ngoài cùng có khả năng, tham gia hình thành liên kết hoá học được gọi là các electron hoá trị.
Thí dụ, cacbon có cấu hình electron : 1 s 2 2 s 2 2 p 2 , các electron 2 s 2 2 p 2 là những electron lớp ngoài cùng và là những electron hoá trị.

Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử nguyên tố.
Thí dụ : Liti, natri có le ở lớp ngoài cùng nên thể hiện tính chất của kim loại, oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.

Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).
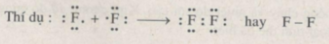

Brom có tính oxi hoầ yếu hơn clo nhưng mạnh hơn iot.
Cl 2 + 2NaBr → 2NaCl + Br 2
Br 2 + 2NaI → 2NaBr + I 2

X : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Số thứ tự bằng số proton và bằng số electron Z = 2 + 2 + 6 + 2 + 6= 18.
Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử nguyên tố.
Thí dụ : Liti, natri có le ở lớp ngoài cùng nên thể hiện tính chất cua kim loại, oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.