Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
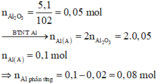
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
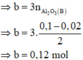
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
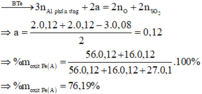

Đáp án A
Ta có sơ đồ phản ứng:
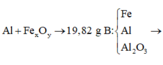
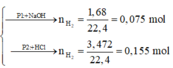
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
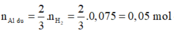
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
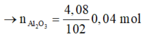
Ta có:
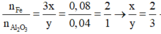
=> Oxit sắt cần tìm là Fe2O3

Đáp án C
Phản ứng: 8 Al + 3 Fe 3 O 4 → t o 4 Al 2 O 3 + 9 Fe
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên trong hỗn hợp có Al dư sau phản ứng. Do đó sau phản ứng, ta thu được hỗn hợp gồm Al, Fe và Al2O3.
Vì khối lượng hai phần bằng nhau nên số mol mỗi chất trong mỗi phần cũng bằng nhau.
Phần 1 tác dụng với dung dịch NaOH có:
n Al = 2 3 n H 2 = 0 , 75 ( mol )
Phần 2 tác dụng với dung dịch HNO3 có:
n NO 2 = 3 n Al + 3 n Fe ⇒ n Fe = n NO 2 - 3 n Al 3 = 0 , 1
Do đó tổng khối lượng hai phân có nF =2.0,1 = 0,2 (mol)
Vậy mFe =0,2.56 = 11,2 (gam)

Đáp án C
Xét phần 1: quy Y về Fe, Cr, Al và O ![]()
-Xét phần 2: bảo toàn nguyên tố Hidro: ![]()
=> bảo toàn nguyên tố Oxi:
![]()
Quay lại phần 1, bảo toàn electron: ![]()
Xét phần 2: bảo toàn khối lượng: ![]()
Lại có: ![]() đều phản ứng với NaOH theo dạng:
đều phản ứng với NaOH theo dạng:
![]()
![]()
= (0,04 + 2a) mol
Bảo toàn nguyên tố Al và Cr: ![]()
Bảo toàn nguyên tố Natri: ![]()
Bảo toàn khối lượng:![]()
![]()
![]()
![]()
![]()

Đáp án C


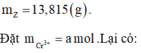
![]()
đều phản ứng với NaOH theo dạng:
![]()
![]()
Bảo toàn nguyên tố Al và Cr
![]()
Bảo toàn nguyên tố Natri: ![]()
Bảo toàn khối lượng:
13,815 + 40x (0,27 + a) = 6,6 + 0,25 × 58,5 + 0,02 × 82+ 107a + 18 × (0.04 + 2a)
=> a = 0,01 mol => x = 0,27 + 0,01 = 0,28 mol

nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
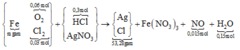
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A
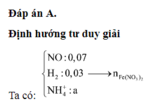
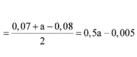
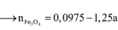
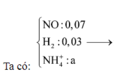
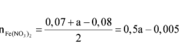
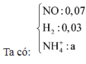
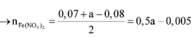
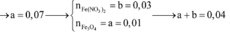
- Hỗn hợp rắn sau pư gồm: Fe và FeCl3.
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: \(2n_{Fe}=2n_{H_2}\Rightarrow n_{Fe}=0,1\left(mol\right)\)
BTNT Fe, có: \(n_{FeCl_3}=n_{Fe\left(OH\right)_3}=0,03\left(mol\right)\) = nFe (pư)
BTNT Fe, có: nFe (ban đầu) = nFe + nFeCl3 = 0,13 (mol)
\(\Rightarrow H\%=\dfrac{0,03}{0,13}.100\%\approx23,077\%\)
Tại sao Fe dư mà lại không tác dụng với FeCl3 vậy ạ