Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ca(OH)2 + CO2 → CaCO3 + H2O
Khối lượng bình (1) tăng là khối lượng của H2O = 0,63(g)
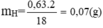
mCaCO3 = 5g ⇒ nCO2 = nCaCO3 = 5/100 = 0,05 mol
BT nguyên tố ⇒ nC = nCO2 = 0,05 mol ⇒ mC = 12. 0,05 = 0,6 g

%mO = 100% - (89,55 + 10,45)% = 0%

Sản phẩm oxi hoá qua bình (1) đựng dung dịch H2SO4 đặc làm khối lượng bình (1) tăng 0,63 g chính là lượng nước bị giữ lại => mH = 0,63180,6318 x 2 = 0,07 g.
Qua bình (2) chứa dung dịch Ca(OH)2 dư, làm cho bình xuất hiện kết tủa chính là do lượng CO2 bị giữ lại vì tham gia phản ứng sau:
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05 51005100 = 0,05 mol
=> mC = 0,05 x 12 = 0,6 (g).
=> mO = 0,67 - (mC + mH) = 0
Từ đó tính được %mC = 89,55%; %mH = 10,45%.

\(d_{X\ H_2}=43\)
\(\Rightarrow M_X=43.2=86\) \((g/mol)\)
\(X+O_2\rightarrow\left(t^o\right)CO_2+H_2O\)
Bình (1) tăng: \(m_{tăng}=m_{H_2O}=12,6\left(g\right)\)
Bình (2):
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,6 0,6 ( mol )
\(n_{CaCO_3}=\dfrac{60}{100}=0,6\left(mol\right)\)
Bảo toàn C: \(n_C=n_{CO_2}=0,6\left(mol\right)\)
Bảo toàn H: \(n_H=2.n_{H_2O}=2.\dfrac{12,6}{18}=1,4\left(mol\right)\)
\(n_O=\dfrac{8,6-\left(0,6.12+1,4.1\right)}{16}=0\left(mol\right)\)
`->` X gồm có C và H
Đặt CTTQ X: \(C_xH_y\)
\(x:y=0,6:1,4=3:7\)
CTĐG X: \(\left(C_3H_7\right)_n=86\)
\(\Rightarrow n=2\)
`=>` CTPT X: \(C_6H_{14}\)
Đồng phân cấu tạo:
\(CH_3-\left(CH_2\right)_4-CH_3\)
\(CH_3-\left(CH-CH_3\right)-\left(CH_2\right)_2-CH_3\)
\(CH_3-CH_2-\left(CH-CH_3\right)-CH_2-CH_3\)
\(CH_3-CH_2-C-\left(CH_3-CH_3-CH_3\right)\)
\(CH_3-\left(CH-CH_3\right)_2-CH_3\)

Đáp án B
Khi oxi hóa hoàn toàn b-caroten tạo ra CO2 và H2O
H2O bị hấp thụ tại bình H2SO4 đặc(1) => mH2O = m1 tăng = 0,63g => nH = 0,07 mol
CO2 bị hấp thụ tại bình Ca(OH)2 dư (2) => nCaCO3 = nCO2 = 0,05 mol
=> nC : nH = 0,05 : 0,07 = 5 : 7
Vậy CTĐG nhất của b-caroten là C5H7

Đáp án A
Đốt cháy X tạo CO2 và H2O
Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol
Bình 2 giữ lại CO2 : nCaCO3 = nCO2 = 0,3 mol
Có : mC + mH + mO = mX => nO = 0,1mol
=> nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1
Vậy CTĐG nhất của X là C3H8O

nX=0,1 mol
CxHy+\(\left(x+\dfrac{y}{4}\right)\)O2\(\rightarrow\)xCO2+\(\dfrac{y}{2}H_2O\)
- Bình axit bắt H2O: \(m_{H_2O}=5,4g\rightarrow n_{H_2O}=5,4:18=0,3mol\)
- Bình bazo bắt CO2:
CO2+Ca(OH)2\(\rightarrow\)CaCO3+H2O
\(n_{CO_2}=n_{CaCO_3}=\dfrac{30}{100}=0,3mol\)
- Theo PTHH 1 ta có:
x=\(\dfrac{n_{CO_2}}{n_X}=\dfrac{0,3}{0,1}=3\)
\(\dfrac{y}{2}=\dfrac{n_{H_2O}}{n_X}=\dfrac{0,3}{0,1}=3\rightarrow y=6\)
CTPT X: C3H6
- Nếu cho qua bình 2 trước thì bình 2 hấp thụ cả CO2 và H2O nên khối lượng bình 2 tăng: 0,3.44+5,4=18,6g
- Bình 1 hấp thụ H2O nên tăng 5,4 g
- Khối lượng dung dịch bình 2 giảm: 30-18,6=11,4g( do kết tủa tách ra 30g nhiều hơn tổng khối lượng CO2 và H2O là 18,6g)
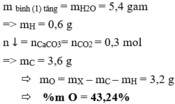
Khối lượng bình (1) tăng 0,63g=> \(m_{H_2O}=0,63\Rightarrow n_{H_2O}=0,035\left(mol\right)\Rightarrow n_H=0,035.2=0,07\left(mol\right)\Rightarrow m_H=0,07\left(g\right)\)
\(m_{CaCO_3}=5\left(g\right)\Rightarrow n_C=n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\Rightarrow m_C=0,05.12=0,6\left(g\right)\)
\(\Rightarrow m_O=0,67-0,07-0,6=0\)
Vậy A ko chứa nguyên tố oxi
\(\Rightarrow\%H=\dfrac{0,07}{0,67}=10,45\%\Rightarrow\%C=100\%-10,45\%=89,55\%\)