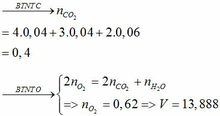Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

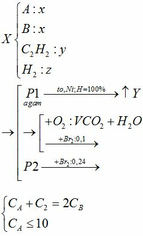
4,72 gam hỗn hợp A: \(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\FeO:b\left(mol\right)\\Fe_2O_3:c\left(mol\right)\end{matrix}\right.\)\(\underrightarrow{H_2,t^o}\)\(\left\{{}\begin{matrix}Fe\\H_2O:0,05\left(mol\right)\end{matrix}\right.\)
4,92 gam hỗn hợp A: \(\left\{{}\begin{matrix}Fe:ka\left(mol\right)\\FeO:kb\left(mol\right)\\Fe_2O_3:kc\left(mol\right)\end{matrix}\right.\)\(\underrightarrow{HCl\left(dư\right)}\)\(H_2:0,03\left(mol\right)\)
\(FeO\left(b\right)+H_2-t^o->Fe+H_2O\left(b\right)\)
\(Fe_2O_3\left(c\right)+3H_2-t^o->2Fe+3H_2O\left(3c\right)\)
Ta có: \(56a+72b+160c=4,72\left(I\right)\)
và \(b+3c=0,05\left(II\right)\)
Gọi k là số lần gấp của số mol hh sau so với bđ
\(\Rightarrow56ka+72kb+160kc=4,92\)
\(\Rightarrow k=\dfrac{4,82}{56a+72b+160c}\left(III\right)\)
\(Fe\left(ka\right)+2HCl\rightarrow FeCl_2+H_2\left(ka\right)\)
\(\Rightarrow ka=0,03\)
\(\Rightarrow k=\dfrac{0,03}{a}\left(IV\right)\)
Từ (III) và (IV) \(\Rightarrow\dfrac{4,92}{56a+72b+160c}=\dfrac{0,03}{a}\)
\(\Leftrightarrow-3,24a+2,16b+4,8c=0\left(V\right)\)
Từ (I) , (II) và (V) => số mol và khối lượng mỗi chất.
Câu b chỉ việc suy ra số mol => tính được thể tích dung dịch
@Nguyễn Xuân Dương
Khí hơi thu được sau thí nghiệm 1 là H2O
Dẫn qua bình H2SO4 đặc => H2O bị giữ lại trong bình
=> Khối lượng bình tăng = khối lượng nước bị hấp thụ vào
=> mH2O = 0,9 (g) = 0,05 (mol)
Ở thí nghiệm 2: Cho hỗn hợp A tác dụng với dung dịch HCl dư
=> Fe + HCl tạo ra khí là H2
nH2 = 0,672/22,4 = 0,03 (mol)

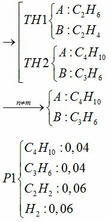
a/ Số mol của HCl = 0,425 x 2 = 0,85mol
Gọi x, y lần lượt là số mol của Al, Mg trong hỗn hợp
Giả sử kim loại phản ứng hết
2Al + 6HCl ===> 2AlCl3 + 3H2
x...........3x...............................1,5x
Mg + 2HCl ===> MgCl2 + H2
y..........2y...............................y
Lập các sô mol trên phương trình, ta có
27x + 24y = 7,5 <=> 27x + 18y < 7,5
<=> (3x + 2y ) x 9 < 7,5 => 3x + 2y < 0,833 (mol) < 0,85
Vì số mol HCl phản ứng bé hơn số mol HCl đầu, nên HCl dư
b/ Chuyển m (gam) CuO thành (m - 5,6) gam chất rắn => Giảm 5,6 gam
Vậy nCuO(pứ) = nO(bị khử) = 5,6 / 16 = 0,35 mol
H2 + CuO =(nhiệt)==> Cu + H2O
0,35...0,35(mol)
Ta có: \(\begin{cases}27x+24y=7,5\\1,5x+y=0,35\end{cases}\)
=> \(\begin{cases}x=0,1\\y=0,2\end{cases}\)
=> mAl = 0,1 x 27 = 2,7 gam
mMg = 7,5 - 2,7 = 4,8 gam

* tac dung voi NaỌH:
Al + NaOH + 3H2O --> Na[Al(OH)4] + 3/2H2
nH2 = 0,12 mol => nAl = 0,08 mol.
* Khi cho them HCl:
FeCO3 + 2HCl ---> FeCl2 + H2O + CO2 (1)
CO2 + Ca(OH)2 --> CaCO3 + H2O
=> n(ket tua) = 0,1 => nCO2 = 0,1 mol.=> nHCl(1) = 0,2 mol
=> n(FeCO3) = nCO2 = 0,1 mol
Fe + 2HCl ---> FeCl2 + H2
*Rắn C chinh ka Cu:
Cu + 4HNO3 ---> Cu(NO3)2 + 2NO2 + 2H2O
n(NO2) = 0,05 mol => nCu = 0,025 mol.
* Cho NaOH dư vao dd D:
Cu(NO3)2 + 2NaOH ---> Cu(OH)2 + 2NaNO3
Cu(OH)2 -------------t0-----> CuO + H2O
nCuO = nCu = 0,025 mol
=> mCuO = 80*0,025 = 2gam.
* Khoi luong cac chat trong hon hop A là:
mAl = 27*0,08 = 2,16 gam.
mFeCO3 = 0,1 * 116 = 11,6 gam
mCu = 64* 0,025 = 1,6 gam.
mFe = 20 - (mFeCO3 + mAl + mCu) = 4,64 gam.

CO tác dụng với hỗn hợp oxit dư thu được khí X là C O 2 .
C O 2 tác dụng với C a O H 2 dư thu được muối duy nhất là kết tủa C a C O 3
⇒ n C O 2 = n N a C O 3 = 4/100 = 0,04 mol
⇒ nCO = n C O 2 = 0,04 mol
⇒ VCO = 0,04.224 = 0,896 lit
⇒ Chọn A.