
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


de day du la
tim cong thuc hoa hoc don gian cua cac hop chat theo cac truong hop sau
Cacbon chiem 48 phan ve khoi luong, hidro chiem 16 phan ve khoi luong

Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)

Phương trình hóa học:
CaCO3 t0→→t0 CaO + CO2
a) Số mol CaO tạo thành sau phản ứng là: nCaO = 11,25611,256 = 0,2 (mol)
Theo phương trình hóa học:
nCaCO3= nCaO = 0,2 (mol)
Vậy cần dùng 0,2 mol CaCO3 để điều chế 11,2 g CaO.
b) Số mol CaO tạo thành sau phản ứng là: nCaO = 756756 = 0,125 (mol)
Theo phương trình hóa học:
nCaCO2 = nCaO= 0,125 (mol)
Khối lượng CaCO3 cần dùng là:
mCaCO3 = M . n = 100 . 0,125 = 12,5 (gam)
Vậy muốn điều chế 7 g CaO cần dùng 12,5 g CaCO3.
c)Theo phương trình hóa học:
nCaCO2 = nCO2 = 3,5 (mol)
VCO2= 22,4 . n = 22,4 . 3,5 = 78,4 (lít)
Vậy 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra 78,4 lít khí CO2 ở đktc.
d) Số mol CO2 tạo thành sau phản ứng là: nCO2nCO2 = 13,4422,413,4422,4 = 0,6 (mol)
Theo phương trình hóa học:
nCaCO3nCaCO3 = nCaOnCaO = nCO2nCO2 = 0,6 (mol)
Khối lượng CaCO3 tham gia là:
mCaCO3mCaCO3 = 0,6 . 100 = 60 (gam)
Khối lượng chất rắn tạo thành là:
mCaO = 0,6 . 56 = 33,6 (gam)

4.a)
nP=\(\dfrac{12,4}{31}\) 0,4 (mol).
n\(_{O_2}\)=\(\dfrac{17}{32}\)= 0,53 (mol).
PTHH :
4P + 5O2 → 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
4.b) Chất được tạo thành là P2O5 . Theo PTHH, ta có :
n\(_{P_2O_5}\)=\(\dfrac{1}{2}\)nP=12.0,4=0,2 (mol).
⇒m\(_{P_2O_5}\) = 0,2.(31.2 + 16.5) = 28,4(g)
5)PTHH:
C + O2 → CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
24. (0,5% + 1,5%) = 0,48kg = 480g.
Khối lượng cacbon nguyên chất là : 24 – 0,48 = 23,52 (kg) = 23520 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
V\(_{CO_2}\)=\(\dfrac{23520}{12}\).22,4= 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 → SO2
Khối lượng tạp chất lưu huỳnh là : 24.0,5% = 0,12 kg = 120 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
V\(_{SO_2}\)=\(\dfrac{120}{32}.22,4\)=84 (l).

Phương trình phản ứng cháy của cacbon :
C + O2 -> CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
24. (0,5% + 1,5%) = 0,48kg = 480g.
Khối lượng cacbon nguyên chất là : 24 – 0,48 = 23,52 (kg) = 23520 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 -> SO2
Khối lượng tạp chất lưu huỳnh là : 24.0,5% = 0,12 kg = 120 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
(lít).
Đổi 24kg = 24000g
pthh C + O2 ---> CO2
theo pthh 1 mol 1 mol 1 mol
theo đề 1960 1960 1960 (mol)
mC=24000*98%/100%=23520(g)
nC=23520/12=1960(mol)
VO2=1960*22.4=43904 (lit)
Ta có pthh S + O2 ----> SO2
theo pthh 1 mol 1 mol 1 mol
theo đề 3.75 mol 3.75 mol 3. 75 mol
mS=24000*0.5%/100%=120(g)
nS=120/32 = 3.75 (mol)
VO2= 22.4 * 3.75 = 84 (lit)

Nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC cho nên ta có thể tách riêng hai khí này bằng cách hạ thấp nhiệt độ để hóa lỏng không khí. Hóa lỏng không khí rồi nâng nhiệt độ xuống của không khí đến -196 oC, nitơ lỏng sôi và bay lên trước, còn oxi lỏng đến - 183 oC mới sôi, tách riêng được hai khí.
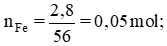
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Lượng chất CO2 cần dùng:
Theo phương trình phản ứng, để thu được một chất khí duy nhất là CO2 thì số mol các chất tham gia phản ứng phải theo đúng tỉ lệ của phương trình hóa học. Ta có:
cau c ?