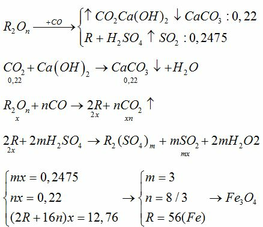Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

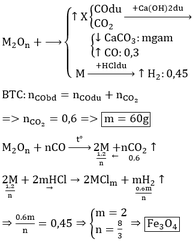
n CO = 6,72/22,4 = 0,3(mol)
n H2 = 2,24/22,4 = 0,1(mol)
B gồm : CO(x mol) ; CO2(y mol)
M B = 18.2 = 36
x + y = 0,3
28x + 44y = 36(x + y)
=> x = y = 0,15
$CO + O_{oxit} \to CO_2$
n O(oxit) = n CO2 = 0,15(mol)
=> m M = 8 - 0,15.16 = 5,6(gam)
n là hóa trị của M
$2M + 2HCl \to 2MCl_n + nH_2$
n M = 2/n . nH2 = 0,2/n (mol)
=> 0,2/n . M = 5,6
=> M = 28n
Với n = 2 thì M = 56(Fe)
n Fe = 5,6/56 = 0,1(mol)
n Fe / n O = 0,1/0,15 = 2/3 . Vậy oxit là Fe2O3

Gọi $n_{CuO} = a; n_{PbO} = b$
Ta có :
$80a + 223b = 15,15(1)$
$CuO + CO \xrightarrow{t^o} Cu + CO_2$
$PbO + CO \xrightarrow{t^o} Pb + CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
Theo PTHH :
$n_{CO_2} = a + b = \dfrac{10}{100} = 0,1(2)$
Từ (1)(2) suy ra a = b = 0,05
Vậy :
$m_{CuO} = 0,05.80 = 4(gam)$
$m_{PbO} = 0,05.223 = 11,15(gam)$

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.