Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuO}=2a\left(mol\right)\Rightarrow n_{Fe_2O_3}=a\left(mol\right)\)
\(m_X=80\cdot2a+160a=80\left(g\right)\)
\(\Rightarrow a=0.25\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(n_{H_2}=0.5+0.25\cdot3=1.25\left(mol\right)\)
\(V_{H_2}=1.25\cdot22.4=28\left(l\right)\)
\(m_{cr}=0.5\cdot64+0.5\cdot56=60\left(g\right)\)

a) Gọi số mol H2 là x
=> nH2O=x(mol)
Theo ĐLBTKL: mA+mH2=mB+mH2O
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> VH2=2,75.22,4=61,6(l)
b) Gọi nCuO=a(mol)
nFe2O3=1,5a(mol)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{15}\)
%mCuO=\(\dfrac{0,5.80}{200}\).100%=20%
%mFe2O3=\(\dfrac{0,75.160}{200}\).100%=60%
%mAl2O3=\(\dfrac{\dfrac{20}{15}102}{200}\).100%=20%
c) nH2=\(\dfrac{2,75}{5}\)=0,55(mol)
nFeO(tt)=\(\dfrac{36}{72}\)=0,5(mol)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> H%=\(\dfrac{0,4}{0,5}\).100%=80%

Câu 2:
Ta có: 80nCuO + 160nFe2O3 = 16 (1)
m giảm = 16.25% = 4 (g) = mO (trong oxit)
\(\Rightarrow n_{O\left(trongoxit\right)}=\dfrac{4}{16}=0,25\left(mol\right)\)
BTNT O, có: nCuO + 3nFe2O3 = 0,25 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CuO}=0,1\left(mol\right)\\n_{Fe_2O_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1.80}{16}.100\%=50\%\\\%m_{Fe_2O_3}=50\%\end{matrix}\right.\)
Bạn bổ sung đủ đề câu 3 nhé.
Câu 1:
Ta có: \(n_{CO}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT C, có: nCO2 = nCO = 0,25 (mol)
BTKL, có: mhh + mCO = m chất rắn + mCO2
⇒ m chất rắn = 30 + 0,25.28 - 0,25.44 = 26 (g)

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

`FeO + H_2` $\xrightarrow[]{t^o}$ `Fe + H_2 O`
`a) n_[H_2] = [ 3,36 ] / [ 22,4 ] = 0,15 (mol)`
`n_[FeO] = [ 14,2 ] / 72 = 71 / 360`
Ta có: `[ 0,15 ] / 1 < [ 71 / 360 ] / 1`
`=> FeO` dư
Theo `PTHH` có: `n_[FeO_\text{(p/ứ)}] = n_[H_2] = 0,15 (mol)`
`=> n_[FeO_\text{(dư)}] = 71 / 360 - 0,15 = 17 / 360 (mol)`
_______________________________________________
`b)` Theo `PTHH` có: `n_[Fe] = n_[H_2] = 0,15 (mol)`
`=> m_[Fe] = 0,15 . 56 = 8,4 (g)`

\(\left\{{}\begin{matrix}CuO:a\\Fe2O3:2a\end{matrix}\right.\)
a.\(80a+320a=24\Leftrightarrow a=0.06\)
\(\Rightarrow\left\{{}\begin{matrix}CuO=0.06\\Fe2O3=0.12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}CuO=4.8g\\Fe2O3=19.2g\end{matrix}\right.\)
b.\(CuO+H2\rightarrow Cu+H2O\)
a a a
\(Fe2O3+3H2\rightarrow2Fe+3H2O\)
2a 6a 4a
\(\Rightarrow V_{H2}=\left(a+6a\right)\times22.4=9.408l\)
c.nHCl = 0.2 mol
\(Fe+2HCl\rightarrow FeCl2+H2\)
0.1 0.2
m chất rắn còn lại = mCu + m Fe ban đầu - m Fe bị hòa tan
= \(a\times64+4a\times56-0.1\times56=11.68g\)

a) PTHH : \(FeO+H_2-t^o->Fe+H_2O\)
\(CuO+H_2-t^o->Cu+H_2O\)
Đặt \(\hept{\begin{cases}n_{FeO}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{cases}}\) => \(72x+80y=11,2\left(I\right)\)
Có : \(m_{O\left(lấy.đi\right)}=m_{giảm}=1,92\left(g\right)\)
=> \(n_{O\left(lấy.đi\right)}=\frac{1,92}{16}=0,12\left(mol\right)\) Vì H% = 80% => Thực tế : \(n_{O\left(hh\right)}=\frac{0,12}{80}\cdot100=0,15\left(mol\right)\)
BT Oxi : \(x+y=0,15\left(II\right)\)
Từ (I) và (II) suy ra : \(\hept{\begin{cases}x=0,1\\y=0,05\end{cases}}\)
=> \(\hept{\begin{cases}m_{FeO}=7,2\left(g\right)\\m_{CuO}=4\left(g\right)\end{cases}}\)
b) PTHH : \(Fe+H_2SO_4-->FeSO_4+H_2\)
BT Fe : \(n_{Fe}=n_{FeO}=0,1\left(mol\right)\)
Theo pthh : \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
=> \(V_{H_2}=2,24\left(l\right)\)
BT Cu : \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{CR\left(ko.tan\right)}=0,05\cdot64=3,2\left(g\right)\)

a) Gọi số mol H2 là x
=> \(n_{H_2O}=x\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2}=m_B+m_{H_2O}\)
=> 200 + 2x = 156 + 18x
=> x = 2,75 (mol)
=> \(V_{H_2}=2,75.22,4=61,6\left(l\right)\)
b) Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_2O_3}=1,5a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\end{matrix}\right.\)
=> 80a + 240a + 102b = 200
=> 320a + 102b = 200
PTHH: CuO + H2 --to--> Cu + H2O
a---------------->a
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
1,5a------------------>3a
=> 64a + 168a + 102b = 156
=> 232a + 102b = 156
=> a = 0,5; b = \(\dfrac{20}{51}\)
=> \(\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,5.80}{200}.100\%=20\%\\\%m_{Fe_2O_3}=\dfrac{0,75.160}{200}.100\%=60\%\\\%m_{Al_2O_3}=\dfrac{\dfrac{20}{51}.102}{200}.100\%=20\%\end{matrix}\right.\)
c) \(n_{H_2}=\dfrac{2,75}{5}=0,55\left(mol\right)\)
\(n_{FeO\left(tt\right)}=\dfrac{36}{72}=0,5\left(mol\right)\)
Gọi số mol FeO phản ứng là t (mol)
PTHH: FeO + H2 --to--> Fe + H2O
t--------------->t
=> 56t + (0,5-t).72 = 29,6
=> t = 0,4 (mol)
=> \(H\%=\dfrac{0,4}{0,5}.100\%=80\%\)

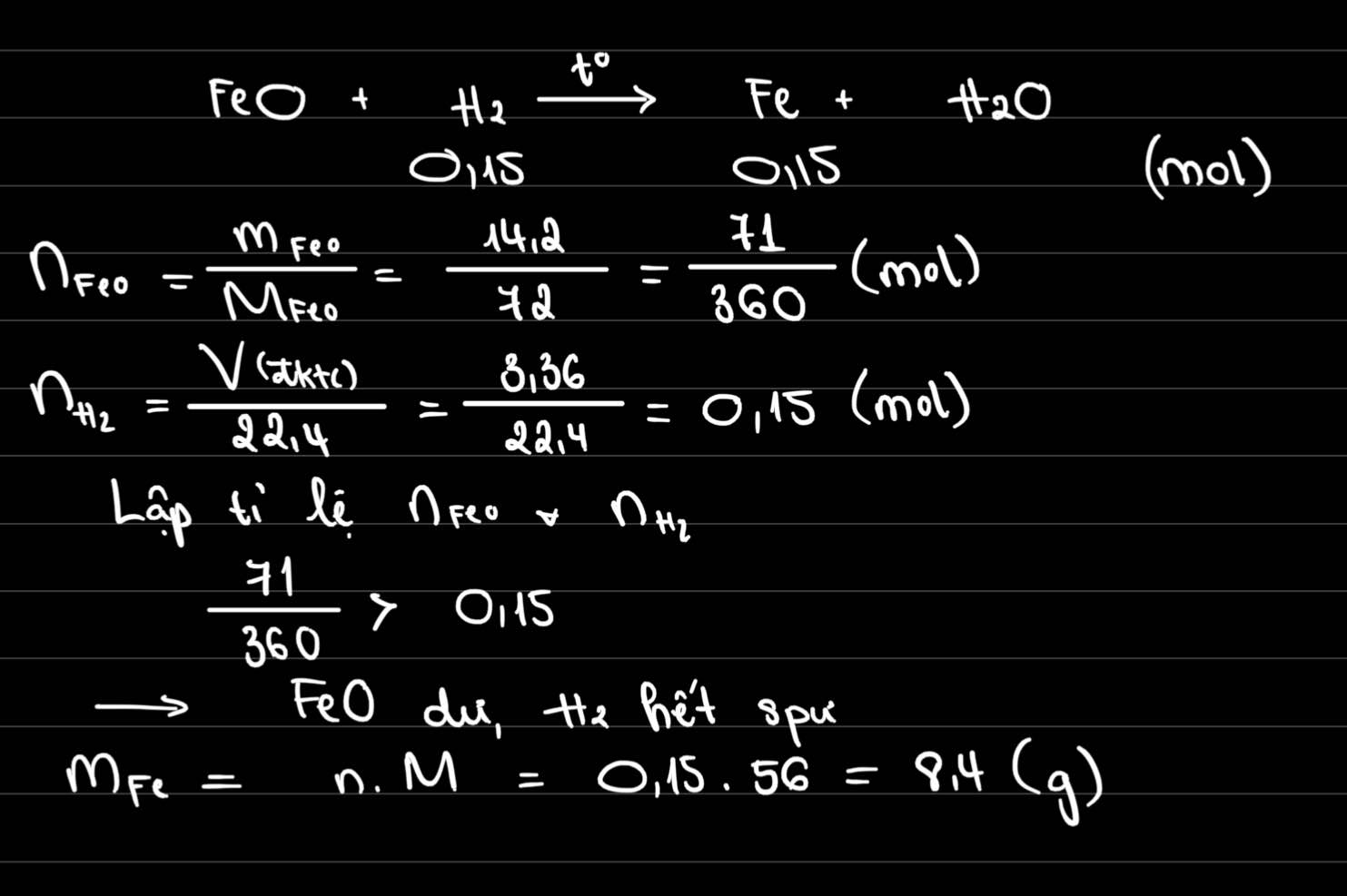
\(n_{CuO}=4a\left(mol\right)\Rightarrow n_{FeO}=a\left(mol\right)\)
\(m_X=80\cdot4a+72a=19.6\left(g\right)\)
\(\Rightarrow a=0.05\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(FeO+H_2\underrightarrow{^{^{t^0}}}Fe+H_2O\)
\(m_{cr}=0.2\cdot64+0.05\cdot56=15.6\left(g\right)\)
\(V_{H_2}=\left(0.05\cdot4+0.05\right)\cdot22.4=5.6\left(l\right)\)