Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
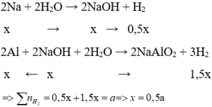
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
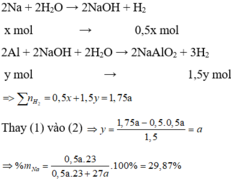

Coi V = 22,4(lít)
Thí nghiệm 1 : $Al$ dư
$n_{H_2} = 1(mol)$
Gọi $n_{Na} = a(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 0,5a + 1,5a = 1 \Rightarrow a = 0,5(mol)$
Thí nghiệm 2 : $Al$ hết
Gọi $n_{Al} = b(mol)$
Theo PTHH :
$n_{H_2} = \dfrac{1}{2}n_{Na} + \dfrac{3}{2}n_{Al}$
$\Rightarrow \dfrac{1}{2}.0,5 + \dfrac{3}{2}b = 1,75$
$\Rightarrow b = 1(mol)$
Ta có :
$\%m_{Na} = \dfrac{0,5.23}{0,5.23 + 1.27}.100\% = 29,87\%$
Đáp án D

Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
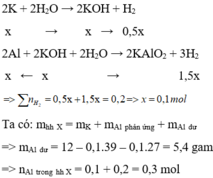
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH
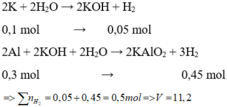

-Gọi số mol Na là x, số mol Al là y
-X tác dụng với H2O:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
x.....\(\leftarrow\)x\(\rightarrow\).....................................\(\dfrac{3x}{2}\)
V=(\(\dfrac{x}{2}+\dfrac{3x}{2}\)).22,4=2x.22,4 lít(I)
-X tác dụng với NaOH:
2Na+2H2O\(\rightarrow\)2NaOH+H2
x\(\rightarrow\).................x............\(\dfrac{x}{2}\)
2Al+2NaOH+2H2O\(\rightarrow\)2NaAlO2+3H2
y\(\rightarrow\)..............................................\(\dfrac{3y}{2}\)
1,75V=\(\left(\dfrac{x}{2}+\dfrac{3y}{2}\right).22,4=\left(\dfrac{x+3y}{2}\right).22,4\)lít(II)
-Lập tỉ số: \(\dfrac{\left(II\right)}{\left(I\right)}\)ta có:
\(1,75=\dfrac{\dfrac{x+3y}{2}}{2x}=\dfrac{x+3y}{4x}\)
\(\rightarrow\)1,75.4x=x+3y\(\rightarrow\)7x=x+3y\(\rightarrow\)6x=3y\(\rightarrow\)2x=y
%Na=\(\dfrac{23x}{23x+27y}.100=\dfrac{23x.100}{23x+27.2x}=\dfrac{2300}{23+27.2}\approx29,87\%\)

\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
Cho X vào dung dịch `H_2SO_4` loãng:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,025<-----------------------0,025
a. \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,025.100\%}{11,8}=11,86\%\\\%m_{Cu}=\dfrac{\left(11,8-0,025.56\right).100\%}{11,8}=88,14\%\end{matrix}\right.\)
b. \(n_{Cu}=\dfrac{11,8-0,025.56}{64}=0,1625\left(mol\right)\)
Cũng lượng X trên cho vào dung dịch `H_2SO_4` đặc nóng:
Giả sử Fe tác dụng hết với dung dịch \(H_2SO_{4.đn}\)
\(2Fe+6H_2SO_{4.đn}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,025----------------------------------->0,0375
\(Cu+2H_2SO_{4.đn}\rightarrow CuSO_4+SO_2+2H_2O\)
0,1625--------------------------->0,1625
\(\Sigma n_{SO_2}=0,0375+0,1625=0,2\left(mol\right)\)
Có: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Phản ứng giữa `NaOH` và `SO_2` tạo muối axit trước (tỉ lệ 1:1)
\(SO_2+NaOH\rightarrow NaHSO_3\)
0,2---->0,2------->0,2
Xét \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\Rightarrow\) NaOH dư.
\(n_{NaOH.dư}=0,25-0,2=0,05\left(mol\right)\)
\(NaOH+NaHSO_3\rightarrow Na_2SO_3+H_2O\)
0,05----->0,05---------->0,05
Xét \(\dfrac{0,05}{1}< \dfrac{0,2}{1}\Rightarrow NaHSO_3.dư\)
Sau phản ứng thu được: \(\left\{{}\begin{matrix}n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\\n_{Na_2SO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,15.104+0,05.126=21,9=m_{muối.thu.được.theo.đề}\)
=> Giả sử đúng.
\(\Rightarrow V=V_{SO_2}=0,2.22,4=4,48\left(l\right)\)

Gọi $n_{Na} = a(mol) ; n_{Ba} = b(mol) \Rightarrow 23a + 137b = 5,49(1)$
$2Na + 2H_2O \to 2NaOH + H_2$
$Ba + 2H_2O \to Ba(OH)_2 + H_2$
$n_{H_2} = 0,5a + b = \dfrac{1,344}{22,4} = 0,06(2)$
Từ (1)(2) suy ra a = 0,06 ; b = 0,03
$CO_2 + Ba(OH)_2 \to BaCO_3 + H_2O$
$n_{CO_2} = n_{Ba(OH)_2} = 0,03 \Rightarrow V = 0,03.22,4 = 0,672(lít)$

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
xem chùa haha