Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

Gọi :$n_{Al} = a ; n_K = b$
Thí nghiệm 1 :
\(2K+2H_2O\text{→}2KOH+H_2\)
b 0,5b (mol)
\(2Al+2H_2O+2KOH\text{→}2KAlO_2+3H_2\)
b 1,5b (mol)
Suy ra : $0,5b + 1,5b = \dfrac{4,48}{22,4} = 0,2$
Suy ra : b = 0,1
Thí nghiệm 2 :
\(2K+2H_2O\text{→}2KOH+H_2\)
0,1 0,05 (mol)
\(2Al+2KOH+2H_2O\text{→}2KOH+3H_2\)
a 1,5a (mol)
Suy ra : 0,05 + 1,5a = 0,5
Suy ra : a = 0,3
Vậy m = 0,3.27 + 0,1.39 = 12(gam)

Chất rắn không tan là Al
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} =0,5n_{Na} + 1,5n_{NaOH} = 0,5n_{Na} + 1,5n_{Na} = 2n_{Na} = 0,2(mol)$
$\Rightarrow n_{Na} = 0,1(mol)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$n_{Al} = \dfrac{3}{2}n_{H_2} = 0,1(mol)$
Suy ra:
$n_{Al\ đã\ dùng} = 0,1 + 0,1 = 0,2(mol)$
Suy ra:
$m_{hh} = 0,2.27 + 0,1.23 = 7,7(gam)$

Đáp án C
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
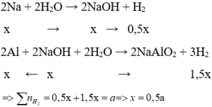
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
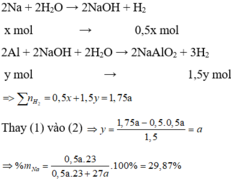

Coi V = 22,4(lít)
Thí nghiệm 1 : $Al$ dư
$n_{H_2} = 1(mol)$
Gọi $n_{Na} = a(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 0,5a + 1,5a = 1 \Rightarrow a = 0,5(mol)$
Thí nghiệm 2 : $Al$ hết
Gọi $n_{Al} = b(mol)$
Theo PTHH :
$n_{H_2} = \dfrac{1}{2}n_{Na} + \dfrac{3}{2}n_{Al}$
$\Rightarrow \dfrac{1}{2}.0,5 + \dfrac{3}{2}b = 1,75$
$\Rightarrow b = 1(mol)$
Ta có :
$\%m_{Na} = \dfrac{0,5.23}{0,5.23 + 1.27}.100\% = 29,87\%$
Đáp án D

Phản ứng nhiệt nhôm:
2 A l + F e 2 O 3 → t 0 A l 2 O 3 + 2 F e ( 1 )
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm A l 2 O 3 , Fe và có thể có F e 2 O 3 dư.
4,4 gam chất rắn không tan có thể gồm Fe và F e 2 O 3 d ư
Phần 2: tác dụng với H 2 S O 4 loãng dư → chỉ có Fe phản ứng sinh ra khí
n H 2 = 1,12 22,4 = 0,05
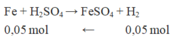
Khối lượng F e 2 O 3 dư ở phần 2 = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
n F e 2 O 3 p u b d đ = 2. 1 2 . n F e ( p 2 ) = 0,05 m o l
Khối lượng F e 2 O 3 ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.
Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH