Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Gọi số mol của Na và Al trong hỗn hợp X lần lượt là x và y mol
Vì tỉ lệ thể tích cũng là tỉ lệ số mol => coi như thí nghiệm 1 thu được a mol khí và thí nghiệm 2 thu được 1,75a mol
Cho hỗn hợp X vào nước, Na phản ứng hết tạo NaOH và Al phản ứng với NaOH và còn dư => tính số mol theo NaOH
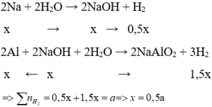
Cho hỗn hợp X tác dụng với dung dịch NaOH dư => Na phản ứng hết với H2O và Al phản ứng hết với NaOH
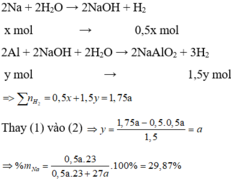

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%

a) \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Cu+HCl\rightarrow\)(không phản ứng)
2Al + 6HCl => 2AlCl3 + 3H2
0,3/3*2 (6,72/22,4)
=> mAl = 0,2 *27 =5,4g; mCu = 11,8 - 5,4 = 6,4g

Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
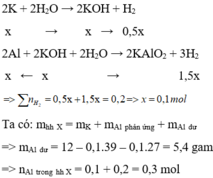
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH
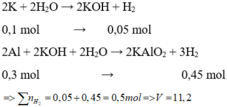

Đặt : nNa = x (mol) , nAl = y (mol)
Nhận xét cả 2 thí nghiệm :
TN1 : m (gam) X tác dụng với nước dư được V lít khí
TN2 : cũng với m (gam) X đó tác dụng với dung dịch NaOH dư thì được 1,75V lít khí
chắc chắn ở tn2 Al sẽ hết vì NaOH dư
=> Thể tích khí bay ra ở tn1 nhỏ hơn tn2 là do ở tn1 Al dư
* TN1
Na + H2O → NaOH + \(\frac{1}{2}\)H2
(mol) x.............................x...................0,5x (mol)
Al + NaOH + H2O → NaAlO2 + \(\frac{3}{2}\)H2
(mol) x ..............x.........................................................1,5x
nAl (dư) = y - x (mol) , NaOH hết
Ta có : (0,5x + 1,5x) * 22,4 = V
=> x = \(\frac{5}{224}V\) (mol)
TN2 :
Na + H2O → NaOH + 1/2 H2
(mol) x...............................x.................0,5x
H2O + NaOH + Al → NaAlO2 + 3/2 H2
(mol) y ..............y....................................1,5y
Ta có : ( 0,5x + 1,5y) * 22,4 = 1,75V
=> 11,2 * \(\frac{5}{224}\)V + 33,6y = 1,75V
<=> y = \(\frac{5}{112}V\) (mol)
Vậy : %mNa = \(\frac{\frac{5}{224}\cdot V\cdot23}{\frac{5}{224}\cdot V\cdot23+\frac{5}{112}\cdot V\cdot27}\cdot100\%\) ~ 29,87 (%)
Giả sử :
V = 22.4 l
Vì : V2 > V1 => ở TN1 : Al dư
Đặt :
nNa (bđ) = x mol
nAl(bđ) = y mol
TN1:
Na + H2O --> NaOH + 1/2H2
x____________x______0.5x
NaOH + Al + H2O --> NaAlO2 + 3/2H2
x_______x____________________1.5x
nH2 = 2x = 1
=> x = 0.5
TN2:
nH2(do Al sinh ra ) = 1.75- 0.5/2 = 1.5 mol
NaOH + Al + H2O --> NaAlO2 + 3/2H2
_______1_____________________1.5
mAl= 27 g
mNa = 11.5 g
%Na = 11.5/ ( 27+ 11.5 ) *100% = 29.87%

- Phần 1 tác dụng với Br2: nBr2 = 16:160 = 0,1 mol
C2H2 + 2Br2 → C2H2Br4
0,05 ← 0,1 (mol)
- Đặt số mol khí mỗi phần như sau:
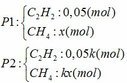
+ Số mol hỗn hợp khí X là: nX = 11,2:22,4 = 0,5 mol
Ta có: n khí P1 + n khí P2 = nX => 0,05 + x + 0,05k + kx = 0,5 <=> (x + 0,05)k = 0,45 - x
=> 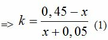
+ Đốt cháy phần 2:
C2H2 + 2,5O2 → t ∘ 2CO2 + H2O
0,05k → 0,1k→ 0,05k (mol)
CH4 + 2O2 → t ∘ CO2 + 2H2O
kx → kx → 2kx (mol)
Sản phẩm cháy gồm
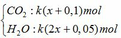
dẫn qua dung dịch Ba(OH)2 dư:
CO2 + Ba(OH)2 → BaCO3↓ + H2O
k(x+0,1) → k(x+0,1) (mol)
Khối lượng dung dịch giảm: m dd giảm = mBaCO3 – mCO2 – mH2O
=> 197k(x+0,1) – 44k(x+0,1) – 18k(2x+0,05) = 69,525
=> 153k(x+0,1) – 18k(2x+0,05) = 69,525
=> k(117x+14,4) = 69,525
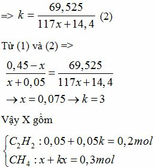
CaC2 + 2H2O → Ca(OH)2 + C2H2
0,2 ← 0,2 (mol)
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
0,1 ← 0,1 (mol)
Giá trị của m là: m = mCaC2 + mAl4C3 = 0,2.64 + 0,1.144 = 27,2 gam
Phần trăm thể tích các khí trong X là:

tác dụng với AgNO3 trong NH3 dư:
C2H2 + 2AgNO3 + 2NH3 → Ag2C2↓ + 2NH4NO3
0,15 → 0,15 (mol)
Khối lượng kết tủa thu được là: mAg2C2 = 0,15.240 = 36 gam
Coi V = 22,4(lít)
Thí nghiệm 1 : $Al$ dư
$n_{H_2} = 1(mol)$
Gọi $n_{Na} = a(mol)$
$2Na + 2H_2O \to 2NaOH + H_2$
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
Theo PTHH :
$n_{H_2} = 0,5a + 1,5a = 1 \Rightarrow a = 0,5(mol)$
Thí nghiệm 2 : $Al$ hết
Gọi $n_{Al} = b(mol)$
Theo PTHH :
$n_{H_2} = \dfrac{1}{2}n_{Na} + \dfrac{3}{2}n_{Al}$
$\Rightarrow \dfrac{1}{2}.0,5 + \dfrac{3}{2}b = 1,75$
$\Rightarrow b = 1(mol)$
Ta có :
$\%m_{Na} = \dfrac{0,5.23}{0,5.23 + 1.27}.100\% = 29,87\%$
Đáp án D
yeahh boyy