Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.

Khối lượng mol trung bình của hỗn hợp khí:
M = 18 x 2 = 36(g/mol)
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí, ta có phương trình đại số :
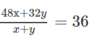
Giải phương trình, ta có y = 3x. Biết rằng tỉ lệ phần trăm về số mol khí cũng là tỉ lệ về thể tích : Thể tích khí oxi gấp 3 lần thể tích khí ozon. Thành phần của hỗn hợp khí là 25% ozon và 75% oxi.

\(n_{O_3} = a ; n_{O_2} = b(mol)\\ M_A = 19,2.2 = 38,4(g/mol)\\ m_{khí} = 48a + 32b = 7,68\\ n_{khí} = a + b = \dfrac{7,68}{38,4} = 0,2\\ \Rightarrow a = 0,08 ; b = 0,12\\ \%V_{O_3} = \dfrac{0,08}{0,2}.100\% = 40\% \Rightarrow \%V_{O_2} = 100\% -40\% = 60\%\\ m_{O_3} = 0,08.48 = 3,84(gam) ; m_{O_2} = 0,12.32 = 3,84(gam)\)

a, Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{O_2}=y\left(mol\right)\end{matrix}\right.\)
Có: \(d_{A/H_2}=12\Rightarrow\dfrac{16x+32y}{x+y}=12.2\)
\(\Rightarrow x=y\)
\(\Rightarrow\%n_{CH_4}=\%n_{O_2}=50\%\)
b, PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Coi x = y = 1 (mol)
Xét tỉ lệ: \(\dfrac{1}{1}>\dfrac{1}{2}\), ta được CH4 dư nếu pư hoàn toàn.
Theo PT: \(\left\{{}\begin{matrix}n_{CH_4\left(pư\right)\left(LT\right)}=n_{CO_2\left(LT\right)}=\dfrac{1}{2}n_{O_2}=0,5\left(mol\right)\\n_{H_2O\left(LT\right)}=n_{O_2}=1\left(mol\right)\end{matrix}\right.\)
Mà: H = 60%
\(\Rightarrow\left\{{}\begin{matrix}n_{CH_4\left(pư\right)\left(TT\right)}=n_{CO_2\left(TT\right)}=0,5.60\%=0,3\left(mol\right)\\n_{H_2O\left(TT\right)}=1.60\%=0,6\left(mol\right)\end{matrix}\right.\)
B gồm: CH4 (dư): 1 - 0,3 = 0,7 (mol); CO2: 0,3 (mol), O2: 1 - 1.60% = 0,4 (mol)
Ở cùng điều kiện nhiệt độ, áp suất thì %V cũng là %n
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,7}{0,7+0,3+0,4}.100\%=50\%\\\%V_{CO_2}=\dfrac{0,3}{0,7+0,3+0,4}.100\%\approx21,4\%\\\%V_{O_2}\approx28,6\%\end{matrix}\right.\)
mH2O = 0,6.18 = 10,8 (g)

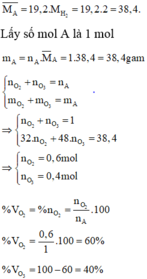
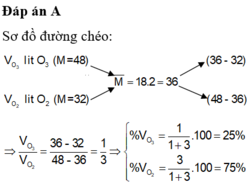
Đặt x và y là số mol O 3 và O 2 có trong 1 mol hỗn hợp khí
Hỗn hợp khí A : (48x + 32y)/(x+y) = 19,2 x 2 = 38,4
→ 3x = 2y → 40% O 3 và 60% O 2
Đặt x và y là số mol H 2 và CO có trong 1 mol hỗn hợp khí
Hỗn hợp khí B : (2x + 28y)/(x+y) = 3,6 x 2 = 7,2
→ x = 4y → 80% H 2 và 20% CO
tại sao lại suy ra đc 3x=2y hả bạn