Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Các phương trình : a,b.
(a) Sn + 2HCl (loãng) → SnCl 2 + H 2
Chất oxi hóa ( sự thay đổi số oxi hóa xảy ra tại H).
(b) Fe + H2SO4(loãng) → FeSO4 + H2
Chất oxi hóa ( sự thay đổi số oxi hóa xảy ra tại H).
(c) MnO 2 + 4 HCl ( đặc ) → MnCl 2 + Cl 2 + 2 H 2 O
Chất khử ( sự thay đổi số oxi hóa xảy ra tại Cl).
(d) Cu + 2 H 2 SO 4 đặc → CuSO 4 + SO 2 + 2 H 2 O
Chất oxi hóa ( sự thay đổi số oxi hóa xảy ra tại S).
(e) 10 FeSO 4 + 2 KMnO 4 + 8 H 2 SO 4 → 5 Fe SO 4 3 + K 2 SO 4 + 2 MnSO 4 + 8 H 2 O
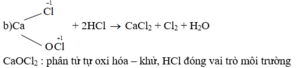
Môi trường

Đáp án là C. 4 ( O2 , F2, HNO3 đặc, nóng; H2SO4 đặc, nóng )

Đáp án C.
S + O2 → SO2
S + 3F2 → SF6
3S + 4HNO3 → 3SO2 + 4NO + 2H2O
S + 2H2SO4 → 3SO2 + 2H2O

Câu 1 :
\(a.Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{t^0}}FeCl_3\)
\(b.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(c.2H_2S+3O_{2\left(dư\right)}\underrightarrow{^{t^0}}2H_2O+2SO_2\)
\(d.2FeS+10H_2SO_{4\left(đ\right)}\underrightarrow{^{t^0}}Fe_2\left(SO_4\right)_3+9SO_2+10H_2O\)
Câu 2 :
Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa đỏ là H2SO4
- mẫu thử nào làm quỳ tím hóa xanh là Na2S
Cho dung dịch Bari clorua vào mẫu thử còn :
- mẫu thử nào tạo kết tủa trắng là MgSO4
\(BaCl_2 +MgSO_4 \to BaSO_4 + MgCl_2\)
- mẫu thử nào không hiện tượng gì là KCl

1)\(N^{-3}H_3+Cl_2\rightarrow N^0_2+HCl\)
\(\left\{{}\begin{matrix}1\times|2N^{-3}\rightarrow N_2^0+6e\left(oxihóa\right)\\3\times|Cl_2^0+2e\rightarrow2Cl^{-1}\left(khử\right)\end{matrix}\right.\)
\(\Rightarrow2NH_3+3Cl_2\rightarrow N_2+6HCl\). Cl là chất oxi hóa và N là chất khử
2)\(N^{-3}H_3+O_2^0\rightarrow N^{+2}O+H_2O^{-2}\)
\(\left\{{}\begin{matrix}4\times|N^{-3}\rightarrow N^{+2}+5e\left(oxihóa\right)\\5\times|O_2^0+4e\rightarrow2O^{2-}\left(khử\right)\end{matrix}\right.\)
\(\Rightarrow4NH_3+5O_2\rightarrow4NO+6H_2O\). N là chất oxi hóa và O là chất khử
3)\(Al^0+Fe^{+\frac{8}{3}}_3O_4\rightarrow Al^{+3}_2O_3+Fe^0\)
\(\left\{{}\begin{matrix}4\times|2Al^0\rightarrow Al_2^{+3}+6e\left(oxihóa\right)\\3\times|Fe^{+\frac{8}{3}}_3+8e\rightarrow3Fe^0\left(khử\right)\end{matrix}\right.\)
\(\Rightarrow8Al+3Fe_3O_4\rightarrow4Al_2O_3+9Fe\)
Fe là chất khử và Al là chất oxi hóa

a)
\(MnO_2 + 4HCl \to MnCl_2 + Cl_2 + 2H_2O\\ Cl_2 + H_2 \xrightarrow{ánh\ sáng} 2HCl\\ NaOH + HCl \to NaCl + H_2O\\ 2NaCl \xrightarrow{đpnc} 2Na + Cl_2\\ Cl_2 + SO_2 + 2H_2O \to 2HCl + H_2SO_4\\ NaCl + H_2SO_4 \xrightarrow{t^o} NaHSO_4 + HCl\)
b)
\(PbO_2 + 4HCl \to PbCl_2 + Cl_2 + 2H_2O\\ 2Na + Cl_2 \xrightarrow{t^o} 2NaCl\\ 2NaCl \xrightarrow{đpnc} 2Na + Cl_2\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ FeCl_3 + 3KOH \to Fe(OH)_3 + 3KCl\\ 2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O\\ Fe_2O_3 + 6HNO_3 \to 2Fe(NO_3)_3 + 3H_2O\)





Fe + 3/2Cl2 -to-> FeCl3
Fe + 2HCl --> FeCl2 + H2
3Fe + 2O2 -to-> Fe3O4
Fe + H2SO4 --> FeSO4 + H2
2Fe + 6H2SO4(đ) -to-> Fe2(SO4)3 + 3SO2 + 6H2O
Al + 3/2Cl2 -to-> AlCl3
2Al + 6HCl --> 2AlCl3 + 3H2
2Al + 3O2 -to-> 2Al2O3
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
2Al + 6H2SO4 (đ) -to-> Al2(SO4)3 + 3SO2 + 6H2O
Zn + Cl2 -to-> ZnCl2
Zn + 2HCl --> ZnCl2 + H2
Zn + 1/2O2 -to-> ZnO
Zn + H2SO4 --> ZnSO4 + H2
Zn + 2H2SO4(đ) -to-> ZnSO4 + SO2 + 2H2O
PTHH: 2Fe +3 Cl2 \(\underrightarrow{t^o}\) 2FeCl3
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
Fe + H2SO4 loãng \(\rightarrow\) FeSO4 + H2\(\uparrow\)
2Fe + 6H2SO4 đặc \(\underrightarrow{t^o}\) Fe2(SO4)3 + 6H2O + 3SO2\(\uparrow\)
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2\(\uparrow\)
4Al + 3O2 \(\underrightarrow{t^o}\) 2Al2O3
2Al + 6H2SO4 đặc \(\underrightarrow{t^o}\) Al2(SO4)3 + 6H2O + 3SO2\(\uparrow\)
2Al + 3H2SO4 loãng \(\rightarrow\) Al2(SO4)3 + 3H2\(\uparrow\)
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2\(\uparrow\)
Zn + H2SO4 loãng \(\rightarrow\) ZnSO4 + H2\(\uparrow\)
Zn + 2H2SO4 đặc \(\rightarrow\) ZnSO4 + 2H2O + SO2\(\uparrow\)