Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng kim loại trong hỗn hợp:
- Số mol H 2 ở (1) và (2) n H 2 = 8,96/22,4 = 0,4 mol
- Đặt x và y là số mol Mg và Al có trong hỗn hợp. Từ (1) và (2) ta có hệ phương trình đại số :
x + 3/2y = 0,4
24x + 27y = 7,8
Giải hệ phương trình, ta được x = 0,1 và y = 0,2.
Khối lượng các kim loại :
m Mg = 0,1 x 24 = 2,4g
m Al = 0,2 x 27 = 5,4g

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
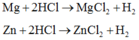
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

\(a)n_{Mg} = a ; n_{Al} = b \Rightarrow 24a +27b = 5,1(1)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{H_2} = a + 1,5b = \dfrac{5,6}{22,4} = 0,25(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,1\\ \%m_{Mg} = \dfrac{0,1.24}{5,1}.100\% = 44,44\%\ ;\ \%m_{Al} = 100\% -44,44\% = 55,56\%\\ b) n_{MgCl_2} = n_{Mg} = 0,1 \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)\\ n_{AlCl_3} = n_{Al} = 0,1 \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ c)n_{HCl} = 2n_{Mg} + 3n_{Al} = 0,5(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,5.36,5}{3,65\%} = 500(gam)\)
\(m_{dd\ sau\ pư} = 5,1 + 500 - 0,25.2 = 504,6(gam)\\ C\%_{MgCl_2} = \dfrac{9,5}{504,6}.100\% = 1,89\%\\ C\%_{AlCl_3} = \dfrac{13,35}{504,6}.100\% = 2,65\%\)

a) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+65b=12,1\) (1)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Bảo toàn electron: \(2n_{Fe}+2n_{Zn}=2n_{H_2}\) \(\Rightarrow2a+2b=0,4\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{12,1}\cdot100\%\approx46,28\%\\\%m_{Zn}=53,72\%\end{matrix}\right.\)
b)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{FeSO_4}=n_{Fe}=n_{Zn}=n_{ZnSO_4}=0,1\left(mol\right)\\n_{H_2SO_4\left(p.ứ\right)}=n_{H_2}=0,2\left(mol\right)\Rightarrow\Sigma n_{H_2SO_4}=0,2\cdot110\%=0,22\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,1\cdot152=15,2\left(g\right)\\m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\\m_{H_2SO_4\left(dư\right)}=\left(0,22-0,2\right)\cdot98=1,96\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{KL}+m_{ddH_2SO_4}-m_{H_2}=211,7\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{15,2}{211,7}\cdot100\%\approx7,18\%\\C\%_{ZnSO_4}=\dfrac{16,1}{211,7}\cdot100\%\approx7,61\%\\C\%_{H_2SO_4}=\dfrac{1,96}{22,4}\cdot100\%\approx0,93\%\end{matrix}\right.\)

a)\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: x 1,5x
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}27x+24y=5,1\\1,5x+y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,1.27.100\%}{5,1}=52,94\%;\%m_{Mg}=100-52,94=47,06\%\)
b)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Mol: 0,1 0,15 0,05
PTHH: Mg + H2SO4 → MgSO4 + H2
Mol: 0,1 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,1+0,15\right).98.100}{9,8}=250\left(g\right)\)
mdd sau pứ = 5,1+250-0,15.2 = 254,8(g)
\(C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{0,05.342.100\%}{254,8}=6,71\%\)
\(C\%_{ddMgSO_4}=\dfrac{0,1.120.100\%}{254,8}=4,71\%\)

\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ n_{H_2} = n_{H_2SO_4} = a(mol)\\ \text{Bảo toàn khối lượng : }\\ 20 + 98a = 58,4 + 2a\\ \Rightarrow a = 0,4\\ \Rightarrow V_1 = \dfrac{0,4}{0,5} = 0,8(lít) = 800(ml)\\ V_2 = 0,4.22,4 = 8,96(lít)\)

Thể tích dung dịch H 2 SO 4 tham gia phản ứng :
Số mol H 2 SO 4 tham gia (1) và (2) là :
0,1 + 0,3 = 0,4 (mol)
Thể tích dung dịch H 2 SO 4 là :
V H 2 SO 4 = 0,4/2 = 0,2 l


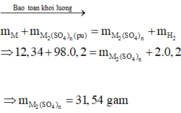

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)
đề ko cho nồng độ phần trăm của dd H2SO4 à