Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Pha chế 50ml dung dịch H 2 S O 4 1,5M.
- Số mol H 2 S O 4 cần pha chế 50ml dung dịch H 2 S O 4 1,5M:
n H 2 S O 4 = CM.V = 1,5.0,05 = 0,075 (mol)
Gọi x(ml) là thể tích của dung dịch H 2 S O 4 1M (1)
Gọi y(ml) là thể tích của dung dịch H 2 S O 4 3M (2)
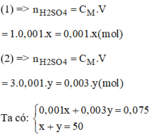
Giải hệ phương trình ta có: x = 37,5ml; y = 12,5ml
- Cách pha chế:
+ Đong lấy 37,5ml dung dịch H 2 S O 4 1M và 12,5ml dung dịch H 2 S O 4 3M cho vào bình, lắc đều, ta được 50ml dung dịch H 2 S O 4 1,5M.

Pha chế 50ml dung dịch C u S O 4 1M
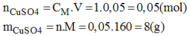
* Cách pha chế:
Cân 8g C u S O 4 cho vào bình. Cho thêm từ từ nước cất vào bình và khuấy đều cho muối tan đến khi đủ 50ml. Ta được 50ml dung dịch C u S O 4 có nồng độ 1M

a)
$m = D.V = 1,109.5.1000 =5545(gam)$
$m_{NaOH} = 5545.10\% = 554,5(gam)$
Pha :
- Cân lấy 554,5 gam NaOH khan cho vào cốc dung dịch 10 lít có chia vạch
- Thêm từ từ nước vào cho đến khi chạm vạch 5 lít, khuấy đều.
b)
$n_{NaOH} = \dfrac{545,5}{40} = 13,8625(mol)$
$C_{M_{NaOH}} = \dfrac{13,8625}{5} = 2,7725M$

1) Thực hành 1
Phần tính toán
Khối lượng chất tan (đường) cần dùng là:
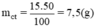
Khối lượng nước cần dùng là: 50 - 7,5 = 42,5(g).
Phần thực hành:
Cần 7,5g đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5g nước, được 50g dung dịch đường 15%.
2) Thực hành 2
Phần tính toán
Số mol NaCl cần dùng là:
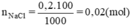
Có khối lượng là: 58,5 x 0,02 = 1,17(g).
Phần thực hành:
Cho 1,17g NaCl khan cho vào cốc chia độ. Rót từ từ nước vào cốc và khuấy đều đến cho vạch 100ml, được 100ml dung dịch NaCl 0,2M.
3) Thực hành 3
Phần tính toán
Khối lượng chất tan(đường) có trong 50g dung dịch đường 5% là:
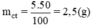
Khối lượng dung dịch đường 15% có chứa 2,5g đường là:
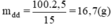
Khối lượng nước cần dùng là: 50 - 16,7 = 33,3(g).
Phần thực hành:
Cần 16,7g dung dịch đường 15% cho vào cốc có dung tích 100ml.Thêm 33,3g nước (hoặc 33,3ml) vào cốc, khuấy đều, được 50g dung dịch đường 5%.
4) Thực hành 4
Phần tính toán
Số mol chất tan (NaCl) có trong 50ml dung dịch 0,1M cần pha chế là:
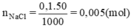
Thể tích dung dịch NaCl 0,2M trong đó có chứa 0,005mol NaCl là:
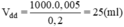
Phần thực hành:
Đong 25ml dung dịch NaCl 0,2M cho vào cốc chia độ. Rót từ từ nước vào cốc đến vạch 50ml. Khuấy đều, được 50ml dung dịch NaCl 0,1M.

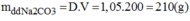
Nồng độ phần trăm của dung dịch pha chế:
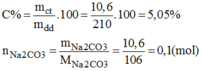
Nồng độ mol của dung dịch:
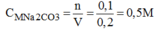

a) Khối lượng đường là
120 . 5% = 6g
Khối lượng nước là :
120 - 6 = 114g
b) Cách pha chế
Cần số gam đường là : 200.10% = 20g
Số gam nước là : 200 - 20 = 180g
Vậy cần 20g đường và 180g nước để pha chế
a)
\(m_{đường} = 120.5\% = 6(gam)\\m_{nước} = m_{dung\ dịch} - m_{đường} = 120 -6 = 114(gam)\)
b)
\(m_{đường} =200.10\% = 20(gam)\\ m_{nước} = 200 -20 = 180(gam)\)
Pha chế :
Cân lấy 20 gam đường cho vào cốc dung tích khoảng 3 lít
Đong lấy 180 gam nước cho vào cốc, khuấy đều.

Bài 1:
Ta có: \(n_{H_2SO_4}=0,05.2=0,1\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
Bài 2:
Ta có: n đường (1) = 2.0,5 = 1 (mol)
n đường (2) = 3.1 = 3 (mol)
⇒ Σn đường = 1 + 3 = 4 (mol)
\(\Rightarrow C_M=\dfrac{4}{2+3}=0,8M\)
Bài 3:
_ Tính toán:
Ta có: \(n_{CuSO_4}=0,075.2=0,15\left(mol\right)\)
\(\Rightarrow m_{CuSO_4}=0,15.160=24\left(g\right)\)
_ Cách pha chế: Cân lấy 24 gam CuSO4 cho vào cốc thủy tinh dung tích 100 ml. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 75 ml dung dịch. Ta được 75 ml dung dịch CuSO4 2M.
Bài 4:
_ Tính toán:
Ta có: \(m_{CuSO_4}=150.7\%=10,5\left(g\right)\)
⇒ mH2O = 150 - 10,5 = 139,5 (g)
_ Cách pha chế: Cân lấy 10,5 gam CuSO4 cho vào cốc có dung tích 200 ml. Cân lấy 139,5 gam (hoặc đong lấy 139,5 ml) nước cất rồi đổ dần vào cốc và khuấy nhẹ, ta được 150 gam dung dịch CuSO4 7%.
Bạn tham khảo nhé!

Bài 1 :
Giả sử thể tích dung dịch H2SO4 là V ml
\(\rightarrow m_{dd}=1,84V\left(g\right)\rightarrow m_{H2SO4}=1,84V.98\%=1,8032\left(V\right)\)
\(\rightarrow n_{H2SO4}=\frac{1,8032V}{98}=0,0184V\left(mol\right)\)
\(\rightarrow CM_{H2SO4}=\frac{0,0184V.1000}{V}=18,4M\)
\(n_{H2SO4}=2.2,5=5\left(mol\right)\rightarrow m_{H2SO4}=5.98=490\left(g\right)\)
\(\rightarrow m_{dd_{H2SO4_{Can}}}=\frac{490}{98\%}=500\left(g\right)\)
Vậy V dung dịch H2SO4 cần \(=\frac{500}{1,84}=271,74\left(ml\right)\)
Cho 271,74 ml H2SO4 98% vào dung dịch, sau đó thêm H2O vào đủ 2 lít/
Bài 2:
Gọi số mol Na2O cần là x \(\rightarrow m_{Na2O}=62x\)
\(\rightarrow\) m dung dịch sau khi thêm=62x+84,5 gam
\(Na_2O+H_2O\rightarrow2NaOH\)
\(\rightarrow n_{NaOH_{tao.ra}}=2x\rightarrow m_{NaOH_{tao.ra}}=2x.40=80x\left(g\right)\)
\(\rightarrow\) m NaOH trong dung dịch \(=80x+84,5.10\%=80x+8,45\left(g\right)\)
\(\rightarrow C\%_{NaOH}=\frac{\left(80x+8,45\right)}{\left(62x+84,5\right)}=28,45\%\rightarrow x=0,25\)
\(\rightarrow m_{Na2O}=15,5\left(g\right)\)
Bài 3 :
\(n_{MgCO3}=\frac{16,8}{84}=0,2\left(mol\right)\)
\(n_{HCl}=\frac{200.10,95\%}{36,5}=0,6\left(mol\right)\)
\(MgCO_3+2HCl\rightarrow MgCl_2+CO_2+H_2O\)
Nên HCl dư
\(n_{CO2}=0,2\left(mol\right)\)
\(n_{HCl_{du}}=0,6-0,2.2=0,2\left(mol\right)\)
\(m_{dd_{Spu}}=16,8+200-0,2.44=208\left(g\right)\)
\(C\%_{HCl}=\frac{0,2.36,5}{208}.100\%=3,51\%\)
\(C\%_{MgCl2}=\frac{0,2.95}{208}.100\%=9,13\%\)

* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.