K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

10 tháng 7 2018
Đáp án A
Theo ĐL BT ĐT thì x = 0,03 mol
Theo ĐLBT ĐT thì nH+ = nClO4(-)+ nNO3(-) = 0,04 mol
H+ + OH- → H2O
0,04 0,03
nH+ dư = 0,01 mol; [H+] dư = 0,01/0,1 = 0,1 suy ra pH = 1

17 tháng 12 2018
Đáp án A
Bảo toàn điện tích:
n OH- = x = nNa+ - 2nSO42- = 0,07 – 0,02.2 = 0,03
n H+ = y = n ClO4- + n NO3- = 0,04 > n OH-
n H+ dư = 0,01 mol
⇒ [H+] = 0,01 : 0,1 = 0,1 ⇒ pH = -log10[H+] = 1

18 tháng 10 2017
Chọn D
Bảo toàn điện tích có: 0,07 + 3a = 0,12 + 0,02.2 → a = 0,03 mol
Cho X vào hỗn hợp KOH và Ba(OH)2:
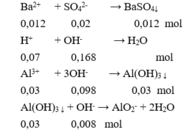
Sau phản ứng thu được kết tủa là:
BaSO 4 0,012 (mol) và Al ( OH ) 3 : 0,03 – 0,008 = 0,022 (mol).
m↓ = 0,012.233 + 0,022.78 = 4,512 gam.
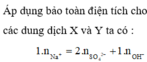



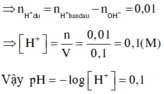
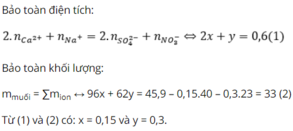
Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 → y = 0,04
Khi trộn dung dịch X và Y thì
H+ + OH- → H2O
(0,04) (0,03)
→ nH+còn dư = 0,04 – 0,03 = 0,01 mol → [H+] còn dư = 0,01/0,1 = 0,1M → pH = – lg[H+] = 1
Đáp án C