Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn điện tích đối với dung dịch X, ta có: 0,07.1 = 0,02.2 + x.1 → x = 0,03
Bảo toàn điện tích đối với dung dịch Y, ta có: y.1 = 0,04.1 → y = 0,04
Khi trộn dung dịch X và Y thì
H+ + OH- → H2O
(0,04) (0,03)
→ nH+còn dư = 0,04 – 0,03 = 0,01 mol → [H+] còn dư = 0,01/0,1 = 0,1M → pH = – lg[H+] = 1
Đáp án C

Đáp án A
Theo ĐL BT ĐT thì x = 0,03 mol
Theo ĐLBT ĐT thì nH+ = nClO4(-)+ nNO3(-) = 0,04 mol
H+ + OH- → H2O
0,04 0,03
nH+ dư = 0,01 mol; [H+] dư = 0,01/0,1 = 0,1 suy ra pH = 1

Đáp án A
Bảo toàn điện tích:
n OH- = x = nNa+ - 2nSO42- = 0,07 – 0,02.2 = 0,03
n H+ = y = n ClO4- + n NO3- = 0,04 > n OH-
n H+ dư = 0,01 mol
⇒ [H+] = 0,01 : 0,1 = 0,1 ⇒ pH = -log10[H+] = 1

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn

Đáp án D
Bảo toàn điện tích với dd X ta có:
0,17. 1 = 0,02.1 + 2nBa2+
=> nBa2+ = 0,075 (mol)
Bảo toàn điện tích với dd Y ta có:
2.0,03 + 1.nHCO3- = 0,1.1
=> nHCO3- = 0,04 (mol)
Trộn dd X với Y xảy ra phản ứng:
OH- + HCO3- → CO32- + H2O
0,04 →0,04 → 0,04 (mol)
Ba2+ + CO32- → BaCO3↓
0,07 ←( 0,03+ 0,04) → 0,07 (mol)
=> m↓ = mBaCO3 = 0,07.197= 13,79 (g)
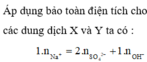


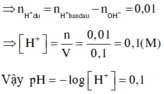

Đáp án C