

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu
Dung dịch N sau phản ứng chứa 3 muối tan, như vậy có khả năng phản ứng trên chưa kết thúc hoặc lượng nhôm ít nên dung dịch N chứa 3 muối Al 2 SO 4 3 , CuSO 4 dư và FeSO 4 chưa phản ứng.

Dung dịch N sau phản ứng chứa 1 muối tan, dung dịch sau phản ứng chỉ có Al 2 SO 4 3 , do Al dư hoặc vừa đủ để phản ứng với 2 muối :
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu ↓
2Al + 3 FeSO 4 → Al 2 SO 4 3 + 3Fe ↓

Dung dịch N sau phản ứng chứa 2 muối tan, nghĩa là lượng AI đã tác dụng hết với CuSO 4 , nên dung dịch N chứa 2 muối Al 2 SO 4 3 và FeSO 4 còn dư (hoặc chưa phản ứng).
2Al + 3 CuSO 4 → Al 2 SO 4 3 + 3Cu ↓

- Do hòa tan A vào nước thu được dd B chỉ chứa 1 chất tan
=> XO tan trong nước tạo ra dd kiềm, Y2O3 tan trong dd kiềm
- B tác dụng với dd Na2SO4 tạo ra kết tủa Z không tan trong axit
=> Z là BaSO4 => XO là BaO
- Sục CO2 dư vào C thu được kết tủa trắng keo
=> C chứa NaAlO2 => Y2O3 là Al2O3
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(Ba\left(OH\right)_2+Al_2O_3\rightarrow Ba\left(AlO_2\right)_2+H_2O\)
\(Ba\left(AlO_2\right)_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaAlO_2\)
\(2NaAlO_2+CO_2+3H_2O\rightarrow Na_2CO_3+2Al\left(OH\right)_3\downarrow\)
\(Na_2CO_3+CO_2+H_2O\rightarrow2NaHCO_3\)

Tóm tắt:
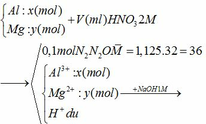
Gọi số mol của N2 và N2O lần lượt là
a và b (mol)
Ta có:
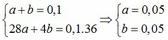


ne (KL nhường) = ne(N+5 nhận)
=> 2x + 3y = 0,5 + 0,4 (1)
Từ đồ thị ta thấy tại giá trị V= 0,1 (lít) tức nNaOH = 0,1 (mol) mới bắt đầu xuất hiện kết tủa=> lượng NaOH này chính là lượng để trung hòa HNO3 dư sau phản ứng=> nHNO3 dư = nNaOH0,1 (mol) Ta thấy tại giá trị V= 1,1 (lít) tức nNaOH = 1,1 (lít) đồ thị đi lên cực đại sau đó lại đi xuống => kết tủa đạt cực đại sau đó bị hòa tan 1 phần ( chỉ có Al(OH)3 bị hoàn tan) Khi cho NaOH từ từ vào dung dich .Z xảy ra phản ứng:
H+ + OH- → H2O
0,1 → 0,1 (mol)
Mg2+ + 2OH- → Mg(OH)2↓
x → 2x (mol)
Al3+ + 3OH- → Al(OH)3↓
y → 3y →y (mol)
Al(OH)3↓ + OH- → AlO2- + 2H2O
(y – z ) → (y –z) (mol)
Gọi số mol của Al(OH)3 còn lại không bị hoàn tan là z (mol)
=> ta có: ∑ nNaOH = nH+dư + 2nMg2+ + 4nAl3+ - nAl(OH)3
=> 0,1 +2x + 4y – z = 1,1 (2)
Mặt khác: ∑ mkết tủa = mMg(OH)2 + mAl(OH)3 chưa hòa tan
=> 58x + 78z = 16,5 (3)
Từ (1), (2) và (3) => x = 0,2 ; y = 0,15 và z = 0,1 (mol)
=> m = mAl + mMg = 0,2.27 + 0,15.24 = 9 (g)
nHNO3 = nHNO3 dư + 2nN2 + 2nN2O + 3nAl(NO3)3 + 2nMg(NO3)2 = 0,1 + 2.0,05 + 2. 0,05 + 3.0,2 + 2.0,15 = 1,2 (mol)
=> VHNO3 = n : CM = 1,2 : 2 = 0,6 (lít) = 600 (ml)

C. ZnSO4, FeSO4, CuSO4
Bạn tra dãy hoạt động hóa học trang 53 SGK hóa 9 nha
Kim loại từ Mg về bên phải thì kim loại đứng trước đẩy kim loại đứng sau ra khỏi dd muối mà Ag đứng sau Cu nên Ag không thể tác dụng CuSO4
Giả sử hỗn hợp toàn Fe, khi này số mol hỗn hợp lớn nhất
\(n_{Fe}=\dfrac{4,62}{56}=0,0825 mol\)
\(Fe + CuSO_4 \rightarrow FeSO_4 + Cu\)
Trước pư: 0,0825 0,15
PƯ: 0,0825 0,0825
Sau PƯ: 0 0,0675
Khi hỗn hợp toàn Fe( số mol lớn nhất) mà CuSO4 vẫn dư nên khi có cả Fe, Zn tác dụng muối thì hỗn hợp thu được là đáp án C