Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2: Hỗn hợp A gồm BaO, FeO, Al2O3. Hòa tan A trong lượng nước dư được dung dịch D và phần không tan B. Sục khí CO2 dư vào D, phản ứng tạo kết tủa. Cho khí CO dư qua B nung nóng được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần và còn lại là chất rắn G. Hòa tan hết G trong lượng dư dung dịch H2SO4 loãng rồi cho dung dịch thu được tác dụng với dung dịch KMnO4. Giải thích thí nghiệm trên bằng các phương trình phản ứng.
________________________________________________________________________
A: BaO + FeO + Al2O3
B: FeO + Al2O3 dư
D: dd Ba(AlO2)2
E: Fe + Al2O3 dư
G: Fe
\(PTHH:BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(Ba\left(OH\right)_2+Al_2O_3\rightarrow Ba\left(AlO_2\right)_2+H_2O\)
\(Ba\left(AlO_2\right)_2+4H_2O+2CO_2\rightarrow Ba\left(HCO_3\right)_2+2Al\left(OH\right)_3\)
\(FeO+CO\underrightarrow{t^o}Fe+CO_2\)
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(10FeSO_4+8H_2SO_4+2KMnO_4\rightarrow5Fe_2\left(SO_4\right)_3+8H_2O+2MnSO_4+K_2SO_4\)
Bài 3: Cho một lá sắt có khối lượng 5g vào 50ml dung dịch CuSO4 15% có khối lượng là 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô, cân nặng 5,16g. Tính nồng độ % các chất còn lại trong dung dịch sau phản ứng
_______________________________________________________________________
Gọi số mol Fe là x (mol)
\(PTHH:Fe+CuSO_4\rightarrow FeSO_4+Cu\)
(mol)_____x_____x_________x_____x__
(mol)
Theo đề bài ta có:
\(\Delta m=64x-56x=5,16-5\\ \Leftrightarrow8x=0,16\\ \Leftrightarrow x=0,02\left(mol\right)\)
\(m_{ddCuSO_4}=50.1,12=56\left(g\right)\\ n_{CuSO_4}=\frac{56.15}{100.160}=0,0525\left(mol\right)\)
Lập tỉ lệ: \(\frac{0,02}{1}< \frac{0,0525}{1}\rightarrow CuSO_4\) dư
\(m_{ddspu}=0,02.56+56-64.0,02=55,84\left(g\right)\)
\(C\%_{ddNaCl}=\frac{0,02.152}{55,84}.100\%=5,44\left(\%\right)\)
\(C\%_{ddCuSO_4\cdot du}=\frac{160.\left(0,0525-0,02\right)}{55,84}.100\%=9,31\left(\%\right)\)

T gồm : $Cu(x\ mol) ; Ag(2x\ mol) ; Fe$ dư(y mol)
Suy ra: $64x + 108.2x + 56y = 61,6(1)$
$n_{Fe\ pư} = a - y(mol)$
Bảo toàn electron :
$(a- y).2 + 0,25.2 = 2x + 2x(2)$
$2x + 2x + 3y = 0,55.2(3)$
Từ (1)(2)(3) suy ra a = 0,25 ; x = 0,2 ; y = 0,1
T gồm 3 kim loại là Cu (x), Ag (2x) và Fe dư (y)
\(m_T=64x+108\cdot2x+56y=61.6\left(g\right)\left(1\right)\)
Bảo toàn e :
\(2x+2x+3y=0.55\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
Bảo toàn electron:
\(2\cdot\left(a-0.1\right)+0.25\cdot2=2\cdot0.2+0.2\cdot2\)
\(\Rightarrow a=0.25\)

Ta thấy \(n_{NO3}=0,08 mol< n_{Zn}=0,09 mol=>Zn\) dư và muối trong dung dịch sau cùng là 0,04 mol Zn(NO3)2
Bảo toàn khối lượng: mZn + ,my = \(m_{dd cuối}\) +\(m_{rắn cuối}\)
=> mY = 0,04.189 + 10,53 – 5,85 = 12,24g
Bảo toàn khối lượng : mCu + mdd AgNO3 = mX + mY
=> mCu = m = 7,76 + 12,24– 0,08.170 = 6,4g.



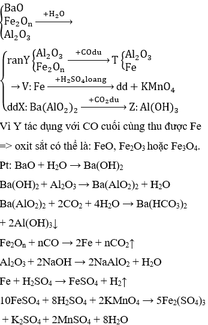

$B : Ag,Cu$
$A_1 : AgNO_3,Fe(NO_3)_3,Cu(NO_3)_2$
$B_2 : Ag,Cu$
$A_2 : Mg(NO_3)_2,Fe(NO_3)_2$