Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: A.
Phương trình hóa học:
![]()
Số mol khí
N
O
2
: 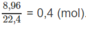
Theo phương trình hoá học :
n M = 0,2 mol và
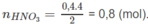
Khối lượng mol nguyên tử của kim loại M :
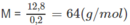
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch H N O 3 60,0%. Ta có phương trình liên hệ V với n H N O 3 :
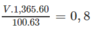
⇒ V = 61,5 ml

a) \(M_A=15.2=30\left(g/mol\right)\)
=> A là NO
\(n_{Cu}=\dfrac{0,96}{64}=0,015\left(mol\right)\)
nHNO3 = 0,1.1 = 0,1 (mol)
PTHH: 3Cu + 8HNO3 --> 3Cu(NO3)2 + 2NO + 4H2O
_____0,015->0,04---------->0,015-------->0,01
=> VNO = 0,01.22,4 = 0,224(l)
b) A chứa: 0,015 mol Cu(NO3)2 và 0,06 mol HNO3
=> \(\left\{{}\begin{matrix}Cu^{2+}:0,015\\H^+:0,06\end{matrix}\right.\)
H+ + OH- --> H2O
0,06->0,06
Cu2+ + 2OH- --> Cu(OH)2
0,015->0,03
=> \(n_{OH^-}=0,09\left(mol\right)\) => nNaOH = 0,09 (mol) => \(V_{dd}=\dfrac{0,09}{0,5}=0,18\left(l\right)\)

Đáp án D
Hướng dẫn giải:
Khối lượng dung dịch H3PO4 là mdung dịch= V. D=100. 1,25= 125 gam
→ mH3PO4= 125.31,36/100= 39,2 gam → nH3PO4= 0,4 mol
Bảo toàn nguyên tố P ta có: nP= nH3PO4= 0,4 mol → mP= 12,4 gam

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

\(n_{OH^-}=2n_{H_2}=2\cdot\dfrac{0.448}{22.4}=0.04\left(mol\right)\)
\(n_{HCl}=0.02\left(mol\right)\)
\(OH^-+H^+\rightarrow H_2O\)
\(n_{OH^-\left(dư\right)}=0.04-0.02=0.02\left(mol\right)\)
\(\left[OH^-\right]_{dư}=\dfrac{0.02}{0.2}=0.1\left(M\right)\)
\(pH=14+\log\left[OH^-\right]=14+\log\left[0.1\right]=13.\)
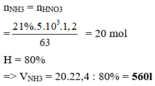
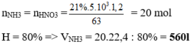
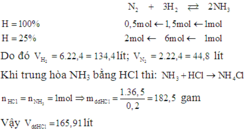

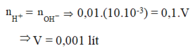
Đáp án B
Các phương trình điều chế HNO3 từ NH3
4NH3 + 5O2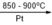 4NO + 6H2O
4NO + 6H2O
2NO + O2→ 2NO2
4NO2 + O2 + 2H2O→ 4HNO3
Theo bảo toàn nguyên tố N ta có:
nNH3= nHNO3=0,05.0,1=5.10-3 mol
→ VNH3=0,112 lít=112 ml