Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Fe} = \dfrac{11,2}{56} =0,2(mol)\\ \Rightarrow m_{tăng} = 11,2 - 0,2.2 = 10,8(gam)\\ 2Al +3 H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{Al} = \dfrac{m}{27}(mol)\\ \Rightarrow n_{H_2} = \dfrac{3}{2}n_{Al} = \dfrac{m}{18}(mol)\)
Vì cân ở vị trí thăng bằng nên :
\(m - \dfrac{m}{18}.2 = 10,8\Rightarrow m =12,15(gam)\)

\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2
\(\Rightarrow m_{Fe}+m_{H_2SO_4}=0,2\cdot56+0,2\cdot98=30,8g\)
Cả hai đĩa cân thăng bằng:
\(m_{Fe}+m_{H_2SO_4}=m_{Al}+m_{H_2SO_4}\)
\(\Rightarrow m_{Fe}=m_{Al}=11,2g\)

Bài của Minh mình thấy chưa được nha chưa trừ đi mH2 đã được giải phóng
- Xét đĩa cân có Al và H2SO4: (Gọi là đĩa A)
\(n_{Al}=\dfrac{m}{27}\left(mol\right)\)
PTHH: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
\(\dfrac{m}{27}\)-->\(\dfrac{m}{18}\)--------------------------->\(\dfrac{m}{18}\)
=> mA (sau pư) = \(m+\dfrac{98m}{18}-\dfrac{2m}{18}=\dfrac{19m}{3}\left(g\right)\)
Xét đĩa cân có Mg và HCl: (Gọi là đĩa cân B)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PTHH: Mg + 2HCl ---> MgCl2 + H2
0,2---->0,4------------------->0,2
=> mB (sau pư) = 4,8 + 0,4.36,5 - 0,2.2 = 19 (g)
Mà mA = mB
\(\rightarrow\dfrac{19m}{3}=19\\ \Leftrightarrow m=3\left(g\right)\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4
=> \(m_{HCl}=0,4.98=39,2\left(g\right)\\
m_{Mg}+m_{HCl}=4,8+39,2=44g\)
vì 2 đĩa cân bằng nhau
=> \(m_{Mg}+m_{HCl}=m_{Al}+m_{H_2SO_4}\)
=> \(m_{Al}=m_{Mg}+m_{HCl}-m_{H_2SO_4}=4,8+39,2-39,2=4,8\left(g\right)\)

Fe + 2HCl → FeCl2 + H2
Theo PTHH :
n H2 = n Fe = 11,2/56 = 0,2(mol)
=> m tăng = m Fe - m H2 = 11,2 - 0,2.2 = 10,8(gam)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
n Al = m/27
n H2 = 3/2 n Al = m/18(mol)
=> m tăng = m Al - m H2 = m - m/18 . 2 = 8m/9(gam)
Vì cân thăng bằng nên : 10,8 = 8m/9
=> m = 12,15 (gam)

Câu hỏi của Dịch Thiên Tổng - Hóa học lớp 8 | Học trực tuyến

nFe = \(\frac{11,2}{56}=0,2mol\)
nAl = \(\frac{m}{27}mol\)
Cốc A : Fe + 2HCl -> FeCl2 + H2
0,2 0,2
Theo định luật bảo toàn khối lượng khối lượng HCl tăng thêm;
11,2 - 0,2.2 = 10,8 g
Cốc B : 2Al + 3H2SO4 -> Al2(SO4)3 + 2H2
\(\frac{m}{27}\) \(\frac{3m}{27.2}\)
Khi cho mg Al vào cốc B thì cốc B tăng thêm là ;
m - \(\frac{3m}{27.2}\).2 = 10,8
=> m = 12,15 g


thiếu đề rồi
nFe =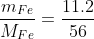
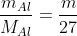
nFe = 0.2 (mol).
nAl =
Xét thí nghiệm 1, ta có phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
0.2 0.4 0.2 0.2 (Mol)
Dung dịch sau phản ứng có chứa: FeCl2 - 0.2 mol và có thể có axit dư
Xét thí nghiệm 2, ta có phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
m/27 m/54 3m/54 (Mol)
Dung dịch sau phản ứng có chứa: Al2(SO4)3 hoặc có thể có axit còn dư
Vì sau khi phản ứng cái kim đồng hồ cân nặng vẫn ở vị trí cân bằng nên ta có thể suy luận như sau:
Khối lượng kim loại Nhôm khi cho vào cốc A trừ đi khối lượng đã mất đi là khí Hidro ở cốc A phải bằng Khối lượng kim loại Nhôm cho vào cốc B trừ đi lượng khí Hidro thoát ra ở cốc B
Vậy ta có phương trình cân bằng khối lượng của 2 cốc như sau:
Cốc A{mFe - mH2} = Cốc B{mAl - mH2}
11.2 - 0.2*2 = m - 6m/54
48m = 583.2
=>m = 12.15 (g)