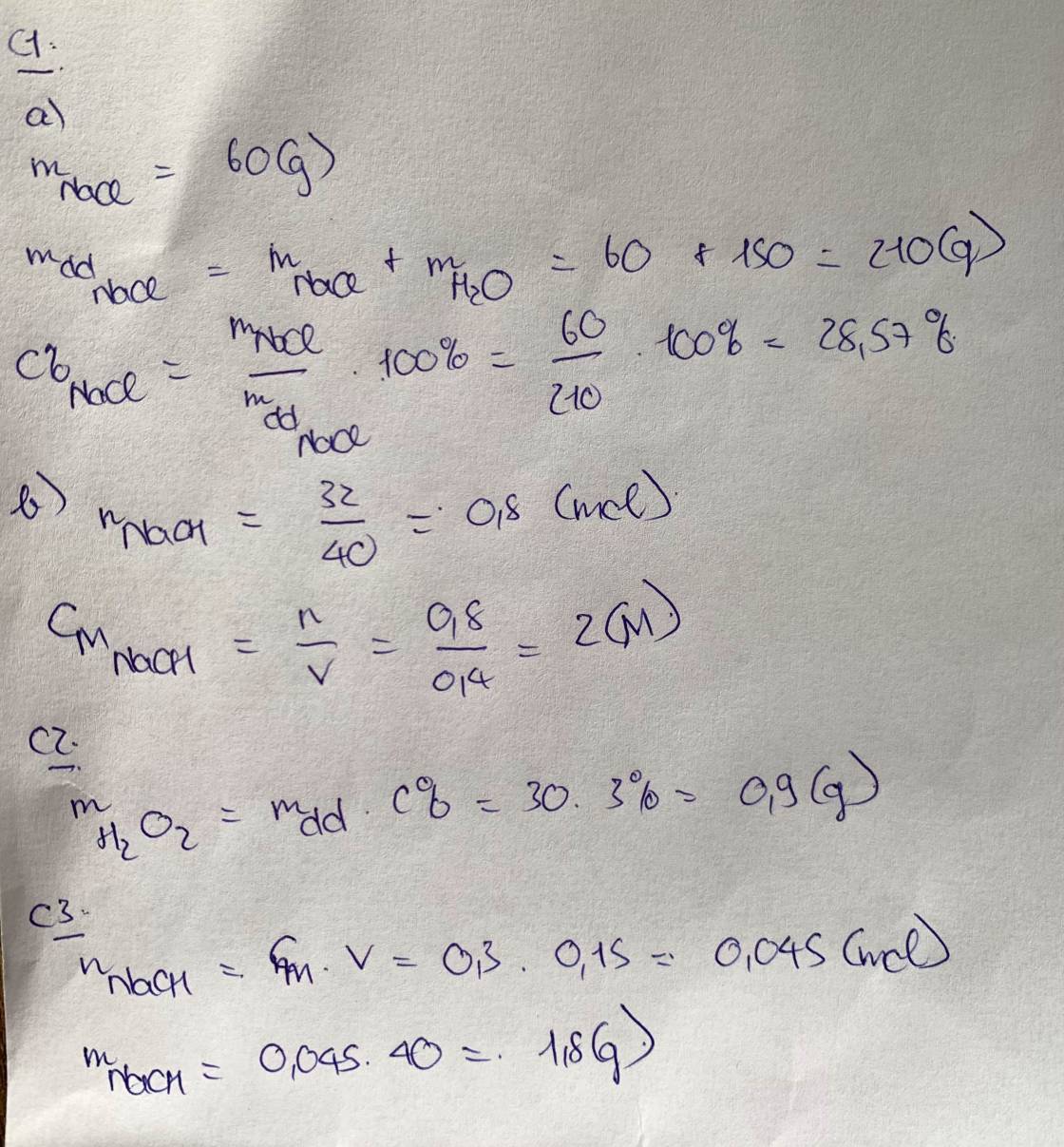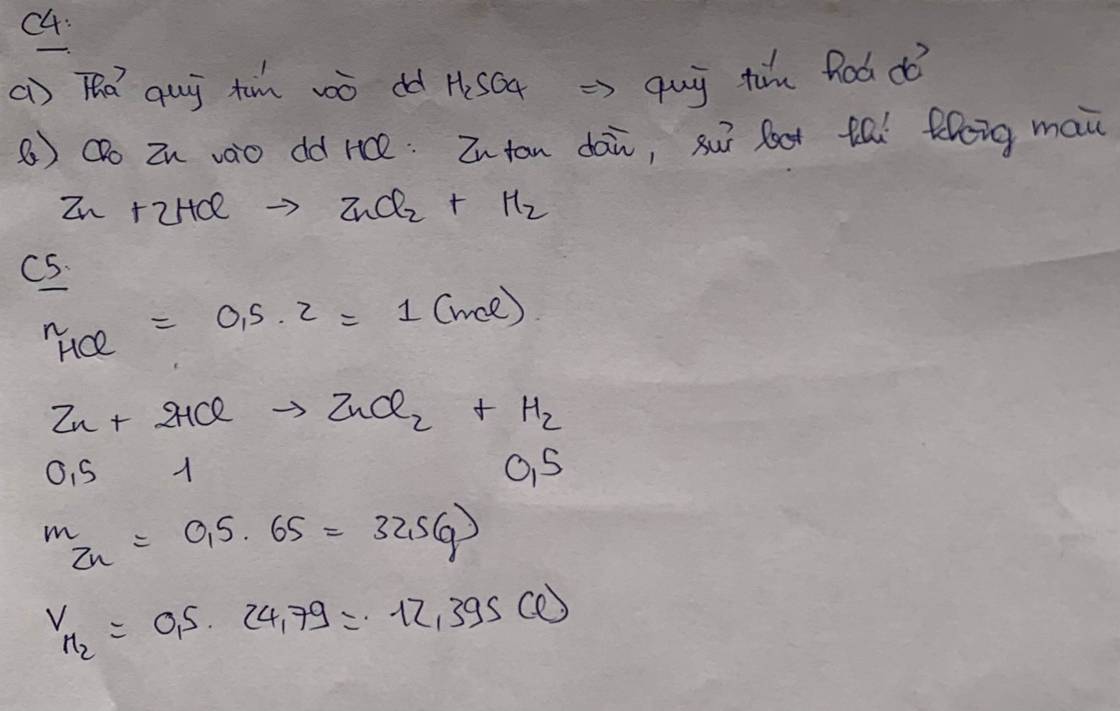Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,Fe + 2HCl → FeCl + H2 (1)
FeO + 2HCl → FeCl + H2O (2)
nH2 = 3,36/ 22,4 = 0,15 ( mol)
Theo (1) nH2 = nFe = 0,15 ( mol)
mFe = 0,15 x 56 = 8.4 (g)
m FeO = 12 - 8,4 = 3,6 (g)
a, \(n_{H_2}=\frac{3,36}{22,4}=0,15\left(mol\right)\)
\(Fe+2HCl->FeCl_2+H_2\left(1\right)\)
\(FeO+2HCl->FeCl_2+H_2O\left(2\right)\)
theo (1) \(n_{Fe}=n_{H_2}=0,15\left(mol\right)\)
=> \(m_{Fe}=0,15.56=8,4\left(g\right)\)
=> \(m_{FeO}=12-8,4=3,6\left(g\right)\)

ta thấy : nFe =nH2 = 0,15
=> mFe =0,15 x 56 = 8,4g
%Fe=8,4/12 x 100 = 70%
=>%FeO = 100 - 70 = 30%
b) BTKLra mdd tìm mct of HCl
c) tìm mdd sau pứ -mH2 nha bạn

\(n_{HCl}=1\cdot0,2=0,2\left(mol\right)\\ PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\\ a,n_{MgO}=\dfrac{1}{2}n_{HCl}=0,1\left(mol\right)\\ \Rightarrow m=m_{MgO}=0,1\cdot40=4\left(g\right)\\ b,n_{MgCl_2}=n_{MgO}=0,1\left(mol\right)\\ \Rightarrow m_{MgCl_2}=0,1\cdot95=9,5\left(g\right)\\ c,m_{CT_{HCl}}=0,2\cdot36,5=7,3\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{7,3}{250}\cdot100\%=2,92\%\)
\(n_{H_2O}=n_{MgO}=0,1\left(mol\right)\\ \Rightarrow m_{H_2O}=0,1\cdot18=1,8\left(g\right)\\ \Rightarrow m_{dd_{MgCl_2}}=4+250-1,8=252,2\left(g\right)\\ \Rightarrow C\%_{MgCl_2}=\dfrac{9,5}{252,2}\cdot100\%\approx3,77\%\)

a)
Khối lượng của dung dịch:
\(m_{dd}=m_{ct}+m_{dm}=20+180=200\left(g\right)\)
Nồng độ phần trăm của dung dịch:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{200}.100\%=10\%\)
b) đề sai nha bạn

a)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4----->0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) mHCl = 0,4.36,5 = 14,6 (g)
=> \(m_{dd.HCl}=\dfrac{14,6.100}{7,3}=200\left(g\right)\)
c)
mdd sau pư = 13 + 200 - 0,2.2 = 212,6 (g)
mZnCl2 = 0,2.136 = 27,2 (g)
=> \(C\%=\dfrac{27,2}{212,6}.100\%=12,8\%\)

1.
nAl=\(\dfrac{5,4}{27}\)=0,2 mol
mHCl=\(\dfrac{175.14,6}{100}\)=25,55g
nHCl=\(\dfrac{25,55}{36,5}\)=0,7
2Al + 6HCl → 2AlCl3 + 3H2↑
n trước pứ 0,2 0,7
n pứ 0,2 →0,6 → 0,2 → 0,3 mol
n sau pứ hết dư 0,1
Sau pứ HCl dư.
mHCl (dư)= 36,5.0,1=3,65g
mcác chất sau pư= 5,4 +175 - 0,3.2= 179,8g
mAlCl3= 133,5.0,2=26,7g
C%ddHCl (dư)= \(\dfrac{3,65.100}{179,8}=2,03%\)%
C%ddAlCl3 = \(\dfrac{26,7.100}{179,8}\)= 14,85%
2.
200ml= 0,2l
mMg= \(\dfrac{4,2}{24}=0,175mol\)
Mg + 2HCl → MgCl2 + H2↑
0,175→ 0,35 → 0,175→0,175 mol
a) VH2= 0,175.22,4=3,92l.
b)C%dHCl= \(\dfrac{0,35}{0,2}=1,75\)M

a)
\(n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,03<------------0,03<----0,015
=> \(\%m_{Na}=\dfrac{0,03.23}{1,31}.100\%=52,67\%\)
=> \(\%m_{Na_2O}=100\%-52,67\%=47,33\%\)
b)
\(n_{Na_2O}=\dfrac{1,31.47,33\%}{62}=0,01\left(mol\right)\)
PTHH: Na2O + H2O --> 2NaOH
0,01----------->0,02
=> nNaOH = 0,03 + 0,02 = 0,05 (mol)
mdd sau pư = 1,31 + 18,72 - 0,015.2 = 20 (g)
=> \(C\%_{dd.NaOH}=\dfrac{0,05.40}{20}.100\%=10\%\)
\(V_{dd.NaOH}=\dfrac{20}{1,2}=\dfrac{50}{3}\left(ml\right)=\dfrac{1}{60}\left(l\right)\)
\(C_{M\left(dd.NaOH\right)}=\dfrac{0,05}{\dfrac{1}{60}}=3M\)