Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cứ 1 mol F e 2 O 3 có 2 mol Fe
Vậy 0,2 mol F e 2 O 3 có x? mol Fe
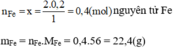
- Trong 0,125 mol phân tử PbO có 0,125 mol nguyên tử Pb.
Khối lượng của Pb = mPb=nPb.MPb=0,125.207=25,875(g)
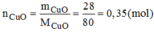
Trong 0,35 mol phân tử CuO có 0,35 mol nguyên tử Cu.
Khối lượng của nguyên tử Cu: M C u = n C u . M C u =0,35.6=22,4(g)

CHÚC BẠN HỌC TỐT!
Câu 2: a) Tui không hiểu đề lắm nên không làm nha!
b) +)\(\left\{{}\begin{matrix}\%Fe=\dfrac{2.56}{2.56+3.16}.100\%=70\%\\\%O=30\%\end{matrix}\right.\)
+)\(\left\{{}\begin{matrix}\%Pb=\dfrac{207}{207+16}.100\%=92,83\%\\\%O=7,17\%\end{matrix}\right.\)
+\(\left\{{}\begin{matrix}\%Cu=\dfrac{64}{64+16}.100\%=80\%\\\%O=20\%\end{matrix}\right.\)
CHÚC BẠN HỌC TỐT!
Câu 1: a) Theo đề bài, ta có:\(\left\{{}\begin{matrix}\%C=\dfrac{12}{12+16+\left(14+2\right).2}.100\%=20\%\\\%O=\dfrac{16}{12+16+\left(14+2\right).2}.100\%\approx26,67\%\\\%N=\dfrac{14.2}{12+16+\left(14+2\right).2}.100\%\approx46,67\%\\\%H=\dfrac{2.2}{12+16+\left(14+2\right).2}.100\%\approx6,67\%\end{matrix}\right.\)
b) Ta có: \(n_{CO\left(NH2\right)2}=0,2.60=12\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_C=12.20\%=2,4\left(g\right)\\m_O=12.26,67\%=3,2004\left(g\right)\\m_N=12.46.67\%=5,6004\left(g\right)\\m_H=12.6,67\%=0,8004\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_C=\dfrac{2,4}{12}=0,2\left(mol\right)\\n_O=\dfrac{3,2004}{16}\approx0,2\left(mol\right)\\n_N=\dfrac{5,6004}{14}\approx0,4\left(mol\right)\\n_H=\dfrac{0,8004}{1}=0,8004\left(mol\right)\end{matrix}\right.\)
Vậy..........

Khối lượng mol của KMnO4 :
MKMnO4 = 39 + 55 + 16.4 = 158 (g/mol)
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{M_{KMnO4}}.100\%=\frac{64}{158}.100\%=40,5\%\)

bài1
ta có dA/H2=22 →MA=22MH2=22 \(\times\) 2 =44
nA=\(\frac{5,6}{22,4}\)=0,25
\(\Rightarrow\)mA=M\(\times\)n=11 g
MA=dA/\(H_2\)×M\(H_2\)=22×(1×2)=44g/mol
nA=VA÷22,4=5,6÷22,4=0,25mol
mA=nA×MA=0,25×44=11g

a)
\(m_C=\dfrac{52,15.46}{100}=24\left(g\right)=>n_C=\dfrac{24}{12}=2\left(mol\right)\)
\(m_H=\dfrac{13,04.46}{100}=6\left(g\right)=>n_H=\dfrac{6}{1}=6\left(mol\right)\)
\(m_O=46-24-6=16\left(g\right)=>n_O=\dfrac{16}{16}=1\left(mol\right)\)
=> CTHH: C2H6O
b) \(n_A=\dfrac{18,4}{46}=0,4\left(mol\right)\)
mC = 12.0,4.2 = 9,6(g)
mH = 1.0,4.6 = 2,4 (g)
mO = 16.0,4.1 = 6,4 (g)
c) \(n_A=\dfrac{13,8}{46}=0,3\left(mol\right)\)
Số nguyên tử C = 2.0,3.6.1023 = 3,6.1023
Số nguyên tử H = 6.0,3.6.1023 = 10,8.1023
Số nguyên tử O = 1.0,3.6.1023 = 1,8.1023

Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.

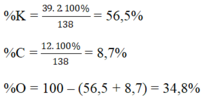
nFe2O3= 32/160=0.2mol
nCuO=28/80=0.35mol
mPbO=223*0.125=27.875g
số ptu Fe2O3=6*10^23*0.2=1.2*10^23(ptu)
=> số ntu Fe = .2*10^23 * 2= 2.4*10^23(ntu);
mFe = 0.2* 56* 2 = 22.4g
%Fe=(22.4/32)*100%=70%
sô ptu PbO = 6*10^23 * 0.125 = 7.5*10^22(ptu)
=>số ntu Pb=7.5*10^22(ntu)
mPb=0.125*207=25.875g
%Pb=(25.875/27.875)*100%=92.83%
số ptu CuO=6*10^23*0.35=2.1*10^23(ptu)
=>số ntu Cu = 2.1*10^23(ntu)
mCu= 0.35*64=22.4g
%Cu=(22.4/28)*100%=80%
\\tham khảo//
1) 32g Fe2O3
\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
Ta có: \(n_{Fe}=2n_{Fe_2O_3}=2\times0,2=0,4\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,4\times56=22,4\left(g\right)\)
\(\%m_{Fe}=\dfrac{22,4}{32}\times100\%=70\%\)
Ta có: \(n_O=3n_{Fe_2O_3}=3\times0,2=0,6\left(mol\right)\)
\(\Rightarrow m_O=0,6\times16=9,6\left(g\right)\)
\(\%m_O=\dfrac{9,6}{32}\times100\%=30\%\)
2) 28g CuO
\(n_{CuO}=\dfrac{28}{80}=0,35\left(mol\right)\)
Ta có:\(n_{Cu}=n_O=n_{CuO}=0,35\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,35\times64=22,4\left(g\right)\)
\(\%m_{Cu}=\dfrac{22,4}{28}\times100\%=80\%\)
\(m_O=0,35\times16=5,6\left(g\right)\)
\(\%m_O=\dfrac{5,6}{28}\times100\%=20\%\)
3) 45g Fe(OH)2
\(n_{Fe\left(OH\right)_2}=\dfrac{45}{90}=0,5\left(mol\right)\)
Ta có: \(n_{Fe}=n_{Fe\left(OH\right)_2}=0,5\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,5\times56=28\left(g\right)\)
\(\%m_{Fe}=\dfrac{28}{45}\times100\%=62,22\%\)
Ta có: \(n_O=n_H=2n_{Fe\left(OH\right)_2}=2\times0,5=1\left(mol\right)\)
\(\Rightarrow m_O=1\times16=16\left(g\right)\)
\(\%m_O=\dfrac{16}{45}\times100\%=35,56\%\)
\(m_H=1\times1=1\left(g\right)\)
\(\%m_H=\dfrac{1}{45}\times100\%=2,22\%\)
4) 0,125 mol PbO
\(m_{PbO}=0,125\times223=27,875\left(g\right)\)
Ta có: \(n_{Pb}=n_O=n_{PbO}=0,125\left(mol\right)\)
\(\Rightarrow m_{Pb}=0,125\times207=25,875\left(g\right)\)
\(\%m_{Pb}=\dfrac{25,875}{27,875}\times100\%=92,83\%\)
\(m_O=0,125\times16=2\left(g\right)\)
\(\%m_O=\dfrac{2}{27,875}\times100\%=7,17\%\)