Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe+2HCl->FeCl2+H2
0,125--0,25---0,125-0,125
m HCl=9,125 g=>n HCl=\(\dfrac{9,125}{26,5}\)=0,25 mol
=>m Fe=0,125.56=7g
=>VH2=0,125.22,4=2,8l
=>C%FeCl2=\(\dfrac{0,125.127}{7+182,5-0,25}\).100=8,388%

\(a) Fe + 2HCl \to FeCl_2\\ b) n_{HCl} = \dfrac{182,5.5\%}{36,5} = 0,25(mol)\\ n_{FeCl_2} = n_{H_2} = n_{Fe} = \dfrac{1}{2}n_{HCl} = 0,125(mol)\\ \Rightarrow m_{Fe} = 0,125.56 = 7(gam) ; V = 0,125.22,4 = 2,8(lít)\\ c) m_{dd\ sau\ phản\ ứng} = m_{Fe} + m_{dd\ HCl} - m_{H_2} = 7 + 182,5 - 0,125.2 = 189,25(gam)\\ C\%_{FeCl_2} = \dfrac{0,125.127}{189,25}.100\% = 8,39\%\)

PTHH: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{10}{40}=0,25\left(mol\right)\\n_{H_2SO_4}=\dfrac{400\cdot49\%}{98}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư, MgO p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{MgSO_4}=0,25\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=1,75\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgSO_4}=0,25\cdot120=30\left(g\right)\\m_{H_2SO_4\left(dư\right)}=1,75\cdot98=171,5\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{MgO}+m_{ddH_2SO_4}=410\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{30}{410}\cdot100\%\approx7,31\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{171,5}{410}\cdot100\%\approx41,83\%\end{matrix}\right.\)
Số mol của magie oxit
nMgO = \(\dfrac{m_{MgO}}{M_{MgO}}=\dfrac{10}{40}=0,25\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{49.400}{100}=196\left(g\right)\)
Số mol của axit sunfuric
nH2SO4= \(\dfrac{m_{H2SO4}}{M_{H2So4}}=\dfrac{196}{98}=2\left(mol\right)\)
a)Pt : MgO + H2SO4 → MgSO4 + H2O\(|\)
1 1 1 1
0,25 2 0,25
b) Lập tỉ số so sánh : \(\dfrac{0,25}{1}< \dfrac{2}{1}\)
⇒ MgO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol MgO
Số mol của muối magie sunfat
nMgSO4 = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
Khối lượng của muối magie sunfat
mMgSO4 = nMgSO4 . MMgSO4
= 0,25 . 120
= 30 (g)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 2 - (0,25 . 1)
= 1,75 (g)
Khối lượng dư của dung dịch axit sunfuric
mdư = ndư . MH2SO4
= 1,75 . 98
= 171,5 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mMgO + mH2SO4
= 10 + 400
= 410 (g)
Nồng độ phần trăm của dung dịch magie sunfat
C0/0MgSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{30.100}{410}=7,32\)0/0
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{171,5.100}{410}=41,83\)0/0
Chúc bạn học tốt

`a)PTHH`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,125` `0,25` `0,125` `0,125` `(mol)`
`n_[HCl]=[5/100 .182,5]/[36,5]=0,25(mol)`
`b)m_[Fe]=0,125.56=7(g)`
`V_[H_2]=0,125.22,4=2,8(l)`
`c)m_[HCl]=0,25.36,5=9,125(g)`
`m_[FeCl_2]=0,125.127=15,875(g)`
`d)C%_[FeCl_2]=[15,875]/[7+182,5-0,125.2] .100~~8,39%`

nZn=0,1 mol
Zn +2HCl=> ZnCl2+ H2
0,1 mol =>0,2 mol
=>mHCl=36,5.0,2=7,3g
=>m dd HCl=7,3/14,6%=50g
mdd sau pứ=6,5+50-0,1.2=56,3g
=>C% dd ZnCl2=(0,1.136)/56,3.100%=24,16%
a.b. Zn + 2HCl ---> ZnCl2 + H2 (1)
Theo pt: 65g 73g 136g 2g
Theo đề: 6,5g 7,3g 13,6g
=> mddHCl=\(\frac{7,3.100}{14,6}=50\left(g\right)\)
c. Từ pt (1), ta có: \(C_{\%}=\frac{13,6}{50+6,5}.100\%=24,1\%\)
![]()

Theo gt ta có: $n_{Al}=0,1(mol)$
a, $2Al+6HCl\rightarrow 2AlCl_3+3H_2$
b, $\Rightarrow n_{H_2}=0,15(mol)\Rightarrow V_{H_2}=3,36(l)$
c, Ta có: $n_{HCl}=0,3(mol)\Rightarrow m_{HCl}=10,95(g)\Rightarrow \%m_{ddHCl}=219(g)$
d, Bảo toàn khối lượng ta có: $m_{dd}=221,4(g)$
$\Rightarrow \%C_{AlCl_3}=6,02\%$

Sửa đề : 11.2 g sắt
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.2....0.2.................0.2\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2}{0.05}=4\left(M\right)\)

a, \(Na_2O+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
b, Số mol \(H_2SO_4\) là: \(n_1=V.C_M=0,5.0,5=0,25\) (mol)
Số mol \(Na_2SO_4\) là \(n_2=\dfrac{28,4}{142}=0,2\) (mol)
Do \(n_2< n_1\) nên \(H_2SO_4\) còn dư
Suy ra số mol \(Na_2O\) tham gia phản ứng là: \(n=n_2=0,2\) (mol)
Khối lượng là: \(m_{Na_2O}=0,2.62=12,4g\)
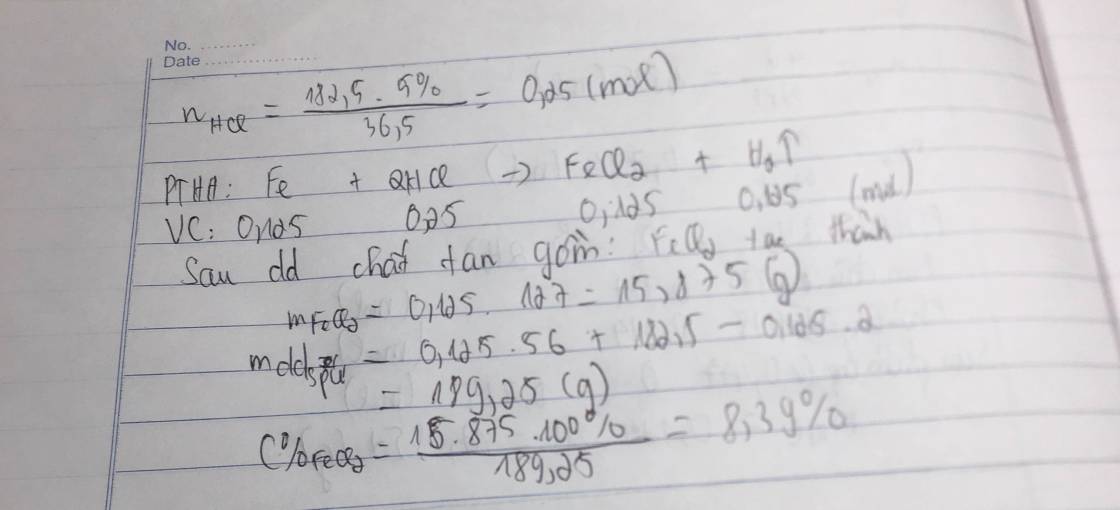

a, \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, Ta có: \(m_{H_2SO_4}=200.9,8\%=19,6\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\left(mol\right)\)
Theo PT: \(n_{MgO}=n_{MgSO_4}=n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=0,2.40=8\left(g\right)\)
c, Ta có: m dd sau pư = 8 + 200 = 208 (g)
\(\Rightarrow C\%_{MgSO_4}=\dfrac{0,2.120}{208}.100\%\approx11,54\%\)