Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
Hỗn hợp (NaX, NaY) = NaM
NaM + AgNO3 → AgM↓+NaNO3
Ta có
![]() => M = 81,6 => X,Y lần lượt là Br (80) và I (127)
=> M = 81,6 => X,Y lần lượt là Br (80) và I (127)

Đáp án D
TH 1: Cả hai muối NaX và NaY đều cho kết tủa khi pư với AgNO3
NaZ + AgNO3 → NaNO3 + AgZ↓
a a
Áp dụng pp tăng giảm khối lượng ![]()
→ a = 0,03 (mol) → MNaZ= 201→ Z = 178
X và Y là I (127) và At (210), nhưng At không có tự nhiên nên TH này loại
TH 2: Chỉ có 1 muối tạo kết tủa nghĩa là hai muối này là NaF và NaCl
nAgCl = 8,61/143,5 = 0,06 mol
NaCl + AgNO3 → NaNO3 + AgCl↓
0,06 0,06
mY = mNaCl = 0,06.58,5 = 3,51g
mX = mNaF = 6,03 - 3,51 = 2,52g
%NaF = ![]() .100% = 41,8%
.100% = 41,8%

TH1: NaF và NaCl
Kết tủa chỉ có AgCl
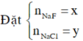
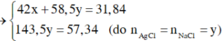
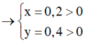
Vậy CT 2 muối có thể là NaF và NaCl
TH2: Hỗn hợp muối không chứa NaF
Đặt CT chung của 2 muối ban đầu là NaX
![]()
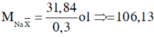
=> 2 muối là NaBr và NaI
Đáp án A



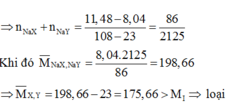

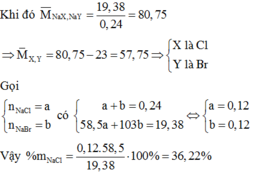

Xét 2 trường hợp:
Trường hợp 1: Giả sử hai muối đều tạo kết tủa:
Gọi Z là halogen đại diện
\(NaZ+AgNO3\rightarrow AgZ+NaNO3\)
\(\dfrac{2,9825}{23+Z}\) \(\dfrac{0,7175}{108+Z}\)
\(\Rightarrow\dfrac{2,9825}{23+Z}=\dfrac{0,7175}{108+Z}\Leftrightarrow Z\approx2,4\) ( loại )
Trường hợp 2: Giả sử chỉ có một muối tạo kết tủa:
⇒ Đó là NaF và NaCl
NaF không phản ứng với AgNO3
NaCl + AgNO3 → AgCl + NaNO3
0,005 ← \(\dfrac{0,7175}{108+35,5}\)
mNaCl = 0,005 . ( 23 + 35,5 ) = 0,2925 (g) ( nhận )
Vậy hai nguyên tố X và Y cần tìm là: F và Cl