Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{HX}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HX --> 2AlX3 + 3H2
0,2--->0,6-------------->0,3
=> \(M_{HX}=\dfrac{21,9}{0,6}=36,5\left(g/mol\right)\)
=> X là Cl
VH2 = 0,3.22,4 = 6,72(l)

Xét 2 trường hợp:
Trường hợp 1: Giả sử hai muối đều tạo kết tủa:
Gọi Z là halogen đại diện
\(NaZ+AgNO3\rightarrow AgZ+NaNO3\)
\(\dfrac{2,9825}{23+Z}\) \(\dfrac{0,7175}{108+Z}\)
\(\Rightarrow\dfrac{2,9825}{23+Z}=\dfrac{0,7175}{108+Z}\Leftrightarrow Z\approx2,4\) ( loại )
Trường hợp 2: Giả sử chỉ có một muối tạo kết tủa:
⇒ Đó là NaF và NaCl
NaF không phản ứng với AgNO3
NaCl + AgNO3 → AgCl + NaNO3
0,005 ← \(\dfrac{0,7175}{108+35,5}\)
mNaCl = 0,005 . ( 23 + 35,5 ) = 0,2925 (g) ( nhận )
Vậy hai nguyên tố X và Y cần tìm là: F và Cl
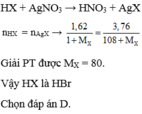
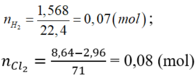
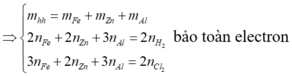
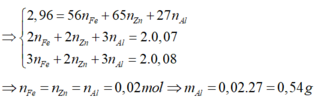


\(n_{HX}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\\ X_2+H_2\rightarrow\left(tu\text{ỳ}.\text{Đ}K\right)2HX\\ n_{X_2}=\dfrac{0,07}{2}=0,035\left(mol\right)\\ M_{X_2}=\dfrac{2,485}{0,035}=71\left(\dfrac{g}{mol}\right)\\ \Rightarrow M_X=35,5\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Clo\left(Cl=35,5\right)\)