Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nMgO= 4:40=0,1(mol) nHCl=1.0,3 =0,3(mol)
a) MgO + 2HCl ---> MgCl2 + H2O
ban đầu: 0,1mol 0,3mol
phản ứng: 0,1mol 0,2mol 0,1mol
sau pứ : 0 0,1 mol 0,1mol
lập tỉ lệ : \(\dfrac{0,1}{1}\) < \(\dfrac{0,3}{2}\)=0,15 =>phản ứng tính theo nMgO (HCl dư)
mddHCl= 1,14.300=342 g => mddsau phản ứng = 342+4=346 g
C%(MgCl2) =\(\dfrac{0,1.95}{346}.100\%\)=2,746%
C%(HCl dư)= \(\dfrac{\left(0,3-0,1.2\right)36,5}{346}.100\%\)=1,05%

a)
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
b)
n HCl = 0,4.1,5 = 0,6(mol)
n Al2O3 = 1/6 n HCl = 0,1(mol) => m = 0,1.102 = 10,2(gam)
n AlCl3 = 1/3 n HCl = 0,2(mol) => CM AlCl3 = 0,2/0,4 = 0,5M

a, \(m_{HCl}=200.14,6\%=29,2\left(g\right)\Rightarrow n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,4 0,8 0,4 0,4
\(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
b, \(m_{Zn}=0,4.65=26\left(g\right)\)
c, mdd sau pứ = 26 + 200 - 0,4.2 = 225,2 (g)
\(C_{M_{ddZnCl_2}}=\dfrac{0,4.136.100\%}{225,2}=24,16\%\)

\(Fe+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Fe+H_2\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{\left(CH_3COO\right)_2Fe}=n_{Fe}=0,2\left(mol\right)\Rightarrow m_{\left(CH_3COO\right)_2Fe}=0,2.174=34,8\left(g\right)\)
Ta có: \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\)
m dd sau pư = 11,2 + 200 - 0,2.2 = 210,8 (g)
\(\Rightarrow C\%_{\left(CH_3COO\right)_2Fe}=\dfrac{34,8}{210,8}.100\%\approx16,51\%\)

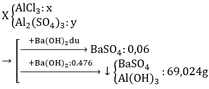
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952


\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ ZnO+2HCl\to ZnCl_2+H_2O\\ b,n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ \Rightarrow n_{Zn}=0,15(mol)\Rightarrow m_{Zn}=0,15.65=9,75(g)\\ \Rightarrow \%_{Zn}=\dfrac{9,75}{25,95}.100\%=37,57\%\\ \Rightarrow \%_{ZnO}=(100-37,57)\%=62,43\%\\ c,n_{ZnO}=\dfrac{25,95-9,75}{81}=0,2(mol)\\ \Rightarrow n_{HCl}=2.0,15+2.0,2=0,7(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{0,7.36,5}{12\%}=212,92(g)\)
Bài 4 :
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=1.0,3=0,3\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,1 0,3 0,1
2) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ MgO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của MgO
\(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgCl2}=0,1.95=9,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,3-\left(0,1.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=1,14.300=342\left(g\right)\)
\(m_{ddspu}=4+342=346\left(g\right)\)
\(C_{MgCl2}=\dfrac{9,5.100}{346}=2,75\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{346}=1,05\)0/0
Chúc bạn học tốt