Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 4 :
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=1.0,3=0,3\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,1 0,3 0,1
2) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ MgO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của MgO
\(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgCl2}=0,1.95=9,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,3-\left(0,1.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=1,14.300=342\left(g\right)\)
\(m_{ddspu}=4+342=346\left(g\right)\)
\(C_{MgCl2}=\dfrac{9,5.100}{346}=2,75\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{346}=1,05\)0/0
Chúc bạn học tốt

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1......................0.1..........0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{dd_{H_2SO_4}}=150\cdot1.08=162\left(g\right)\)
\(m_{dd}=6.5+162-0.1\cdot2=168.3\left(g\right)\)
\(C\%_{ZnSO_4}=\dfrac{0.1\cdot161}{168.3}\cdot100\%=9.56\%\)
cám mơn bạn nha, bạn ơi mik nhờ bạn giải giúp mik thêm bài này được ko?

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
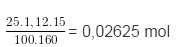
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


PTHH: \(CaO+2HCl\rightarrow CaCl_2+H_2O\) (1)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\) (2)
a) Ta có: \(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{CaCO_3}\)
\(\Rightarrow m_{CaCO_3}=0,2\cdot100=20\left(g\right)\) \(\Rightarrow\%m_{CaCO_3}=\dfrac{20}{25,6}\cdot100\%=78,125\%\)
\(\Rightarrow\%m_{CaO}=21,875\%\)
b) Theo 2 PTHH: \(\left\{{}\begin{matrix}n_{HCl\left(2\right)}=2n_{CaCO_3}=0,4mol\\n_{HCl\left(1\right)}=2n_{CaO}=2\cdot\dfrac{25,6-20}{56}=0,2mol\end{matrix}\right.\)
\(\Rightarrow\Sigma n_{HCl}=0,6mol\) \(\Rightarrow C\%_{HCl}=\dfrac{0,6\cdot36,5}{210\cdot1,05}\cdot100\%\approx9,93\%\)

\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(m_{ct}=\dfrac{3,65.200}{100}=7,3\left(g\right)\)
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
a) Pt : \(CuO+2HCl\rightarrow CuCl_2+H_2O|\)
1 2 1 1
0,05 0,2 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,2}{2}\)
⇒ CuO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuCl2}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{CuCl2}=0,05.135=6,75\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,2-\left(0,05.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddspu}=4+200=204\left(g\right)\)
\(C_{CuCl2}=\dfrac{6,75.100}{204}=3,31\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{204}=1,8\)0/0
Chúc bạn học tốt

Câu 15 :
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,4----->1,2------->0,4------>0,6
\(m_{HCl}=1,2.36,5=43,8\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{43.8.100\%}{25\%}=175,2\left(g\right)\)
\(m_{ddspu}=10,8+175,2-0,6.2=184,8\left(g\right)\)
\(C\%_{AlCl3}=\dfrac{0,4.133,5}{184,8}.100\%=28,9\%\)
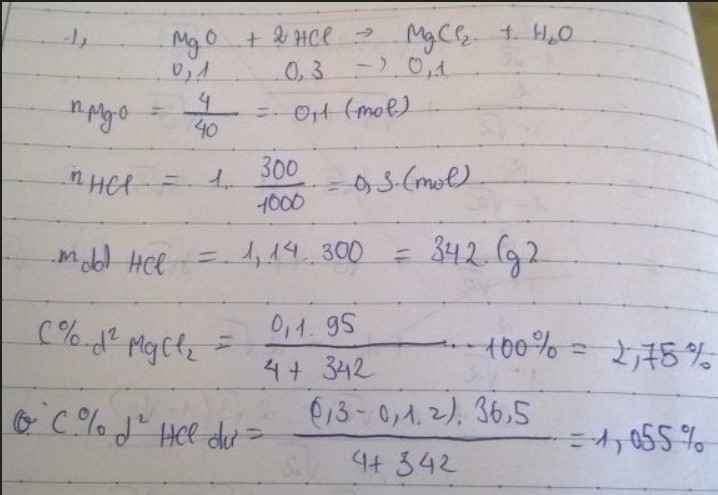
nMgO= 4:40=0,1(mol) nHCl=1.0,3 =0,3(mol)
a) MgO + 2HCl ---> MgCl2 + H2O
ban đầu: 0,1mol 0,3mol
phản ứng: 0,1mol 0,2mol 0,1mol
sau pứ : 0 0,1 mol 0,1mol
lập tỉ lệ : \(\dfrac{0,1}{1}\) < \(\dfrac{0,3}{2}\)=0,15 =>phản ứng tính theo nMgO (HCl dư)
mddHCl= 1,14.300=342 g => mddsau phản ứng = 342+4=346 g
C%(MgCl2) =\(\dfrac{0,1.95}{346}.100\%\)=2,746%
C%(HCl dư)= \(\dfrac{\left(0,3-0,1.2\right)36,5}{346}.100\%\)=1,05%