Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$n_{CaCO_3} = 0,12(mol) ; n_{HCl} = 0,6(mol)
\(CaCO_3+2HCl\text{→}CaCl_2+CO_2+H_2O\)
Ban đầu 0,12 0,6 (mol)
Phản ứng 0,12 0,24 (mol)
Sau pư 0 0,36 0,12 (mol)
$V = 0,12.22,4 = 2,688(lít)$
b)
$n_{Cl^-} = 0,6(mol) ; n_{H^+} = 0,36(mol)$
$n_{Ca^{2+}} = 0,12(mol)$
$[Cl^-] = \dfrac{0,6}{0,2} = 3M$
$[H^+] = \dfrac{0,36}{0,2} = 1,8M$
$[Ca^{2+}] = \dfrac{0,12}{0,2} = 0,6M$
a,\(n_{CaCO_3}=\dfrac{12}{100}=0,12\left(mol\right);n_{HCl}=0,2.3=0,6\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,12 0,12
Ta có: \(\dfrac{0,12}{1}< \dfrac{0,6}{2}\)⇒ HCl dư,CaCO3 pứ hết
\(V_{CO_2}=0,12.22,4=2,688\left(l\right)\)

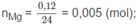
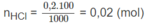
Mg + 2HCl → M g C l 2 + H 2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1. 10 - 11 . 10 - 1 M.
Vậy pH = 1.

\(C_{M_{HCl}}=a\left(M\right),C_{M_{H_2SO_4}}=b\left(M\right)\)
\(n_{HCl}=a\left(mol\right),n_{H_2SO_4}=b\left(mol\right)\)
\(n_{NaOH}=0.4\cdot0.5=0.2\left(mol\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(a..........a.........a\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(2b............b..........b\)
\(n_{NaOH}=a+2b=0.2\left(mol\right)\left(1\right)\)
\(m_{muối}=58.5a+142b=12.95\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.05\)
\(\left[H^+\right]=0.1+0.05\cdot2=0.2\left(M\right)\)
\(\left[Cl^-\right]=0.1\left(M\right)\)
\(\left[SO_4^{2-}\right]=0.05\left(M\right)\)
\(b.\)
\(pH=-log\left(0.2\right)=0.7\)

a)
$KOH + HCl \to KCl + H_2O$
$n_{KOH} = 0,3(mol) < n_{HCl} = 1,05(mol)$ nên HCl dư
$n_{HCl\ dư} = 1,05 -0 ,3 = 0,75(mol)$
$n_{KCl} = n_{KOH} = 0,3(mol)$
$V_{dd} = 0,3+ 0,7 = 1(lít)$
Suy ra :
$[K^+] = \dfrac{0,3}{1} = 0,3M$
$[Cl^-] = \dfrac{0,75 + 0,3}{1} = 1,05M$
$[H^+] = \dfrac{0,75}{1} = 0,75M$
b)
$Ba(OH)_2 + 2HCl \to BaCl_2 + 2H_2O$
$n_{Ba(OH)_2} = \dfrac{1}{2}n_{HCl} = 0,375(mol)$
$V_{Ba(OH)_2} = \dfrac{0,375}{1,5} = 0,25(lít)$
\(n_{KOH}=0.3\cdot1=0.3\left(mol\right)\)
\(n_{HCl}=0.7\cdot1.5=1.05\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.3...........0.3..........0.3\)
Dung dịch D gồm : 0.3 (mol) KCl , 0.75 (mol) HCl dư
\(\left[K^+\right]=\dfrac{0.3}{0.3+0.7}=0.3\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.3+0.75}{0.3+0.7}=1.05\left(M\right)\)
\(\left[H^+\right]=\dfrac{0.75}{0.3+0.7}=0.75\left(M\right)\)
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
\(0.375..................0.75\)
\(V_{dd_{Ba\left(OH\right)_2}}=\dfrac{0.375}{1.5}=0.25\left(l\right)\)

a)nHCl= 0,1 , nNaOh=0,4 khi phân li ra ta thu được các ion; H+, Cl- Na+, OH- Vdung dịch sau = 0,1+0,4=0,5(l)
nH+=nCl-=0,1 [H+]=[Cl-]=0,1/0,5=0,2 (M)
nNa+=nOH-=0,4 [Na+]=[OH-]=0,4/0,5=0,8
b)nH+=0,1 nOH-=0,4 --> OH- dư --> nOHdư=0,4-0,1=0,3 --> [OHdư ]=0,3/0,5=0,6 --> pOh=0,23--> ph=14-0,23=13,77

\(n_{KOH}=0.1\cdot1=0.1\left(mol\right)\)
\(n_{HCl}=0.1\cdot0.5=0.05\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.05.......0.05.......0.05\)
Dung dịch D : 0.05 (mol) KOH , 0.05 (mol) KCl
\(\left[K^+\right]=\dfrac{0.05+0.05}{0.1+0.1}=0.5\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(\left[OH^-\right]=\dfrac{0.05}{0.2}=0.25\left(M\right)\)
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
\(0.05.........0.025\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.025}{1}=0.025\left(l\right)\)
a)
Coi V dd HCl = 100(ml)
m dd HCl = 1,25.100 = 125(gam)
n HCl = 125.7,3%/36,5 = 0,25(mol)
[H+ ] = [Cl- ] = CM HCl = 0,25/0,1 = 2,5M
b)
n Al = 0,235(mol)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
n HCl pư = 3n Al = 0,705(mol)
n HCl dư = 0,4.2 - 0,705 = 0,095(mol)
[H+ ] = CM HCl dư = 0,095/0,4 = 0,2375M
pH = -log([H+ ]) = 0,624