Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
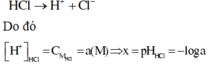
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
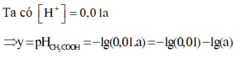
![]()
Đáp án A.

\(a.n_{H^+}=0,025.0,025.2=\dfrac{1}{800}\left(mol\right)\\ \left[H^+\right]=\dfrac{\dfrac{1}{800}}{0,1+0,025}=0,01\left(M\right)\\ \Rightarrow pH=-log\left[0,01\right]=2\\ b.n_{OH^-}=0,0025.0,1=0,00025\left(mol\right)\\ \left[OH^-\right]=\dfrac{0,00025}{0,4+0,1}=\dfrac{1}{2000}\left(M\right)\\ pH=14+log\left[\dfrac{1}{2000}\right]=10,69897\)

Đáp án B
nH+ ban đầu = 0,1.2.0,1 + 0,2.0,1 + 0,3.0,1 = 0,07
dung dịch C có pH=1 ⇒ nH+/C = 0,1.(0,3 + V)
⇒ nH+ ban đầu = nH+/C + nOH- ⇒ 0,07 = 0,1.(0,3 + V) + 0,2V +0,1.2V
⇒ V =0,08l

\(n_{Ba\left(OH\right)_2}=0,3.0,1=0,03\left(mol\right)\\ n_{HCl}=0,2.0,15=0,03\left(mol\right)\\ Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\\ Vì:\dfrac{n_{Ba\left(OH\right)_2\left(đề\right)}}{n_{Ba\left(OH\right)_2\left(PTHH\right)}}=\dfrac{0,03}{1}>\dfrac{n_{HCl\left(đề\right)}}{n_{HCl\left(PTHH\right)}}=\dfrac{0,03}{2}\\ \Rightarrow Ba\left(OH\right)_2dư\\ n_{Ba\left(OH\right)_2\left(p.ứ\right)}=\dfrac{n_{HCl}}{2}=\dfrac{0,03}{2}=0,015\\ n_{Ba\left(OH\right)_2\left(dư\right)}=0,03-0,015=0,015\left(mol\right)\\ \left[OH^-\right]=2.\left[Ba\left(OH\right)_2\left(dư\right)\right]=\dfrac{0,015}{0,3+0,2}=0,03\left(M\right)\\ \Rightarrow pH=14+log\left[OH^-\right]=14+log\left[0,03\right]\approx12,477\)
Nồng độ mol/lít các ion trong dd A:
\(\left[OH^-\left(dư\right)\right]=0,06\left(M\right)\left(nt\right)\\\left[Cl^-\right]=2.\left[BaCl_2\right]=2.\left(\dfrac{0,015}{0,5}\right)=0,06\left(M\right)\\ \left[Ba^{2+}\right]=0,03+ 0,03=0,06\left(M\right)\)

Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
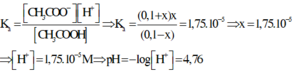
Đáp án D.
a, \(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,1 0 0 (M)
Pư: x x x (M)
Cb: 0,1-x x x (M)
Có: \(K_c=\dfrac{\left[CH_3COO^-\right]\left[H^+\right]}{\left[CH_3COOH\right]}\Rightarrow1,8.10^{-5}=\dfrac{x.x}{0,1-x}\) \(\Rightarrow x\approx1,33.10^{-3}\)
⇒ pH = -log[H+] = 2,88
b, \(CH_3COONa⇌CH_3COO^-+Na^+\)
\(CH_3COO^-+H_2O⇌CH_3COOH+OH^-\)
→ MT base
c, \(n_{NaOH}=0,01.0,1=0,001\left(mol\right)\)
\(n_{CH_3COOH}=0,01.0,2=0,002\left(mol\right)\)
PT: \(NaOH+CH_3COOH\rightarrow CH_3COONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,001}{1}< \dfrac{0,002}{1}\), ta được CH3COOH dư.
Theo PT: \(n_{CH_3COOH\left(pư\right)}=n_{CH_3COONa}=n_{NaOH}=0,001\left(mol\right)\)
\(\Rightarrow n_{CH_3COOH\left(dư\right)}=0,002-0,001=0,001\left(mol\right)\)
→ Dd A gồm: CH3COONa: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\) và CH3COOH: \(\dfrac{0,001}{0,02}=0,05\left(M\right)\)
\(CH_3COOH⇌CH_3COO^-+H^+\)
Bđ: 0,05 0,05 0 (M)
Pư: x x+0,05 x (M)
Cb: 0,05-x x+0,05 x (M)
\(\Rightarrow\dfrac{x\left(x+0,05\right)}{0,05-x}=1,8.10^{-5}\Rightarrow x\approx1,8.10^{-5}\)
⇒ pH = 4,74