Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
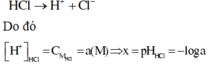
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
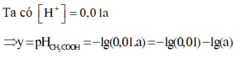
![]()
Đáp án A.

Đáp án B
Vì CH3COONa là chất điện li mạnh nên được viết trước để tạo môi trường cho cân bằng của chất điện li yếu phân li và cân bằng:
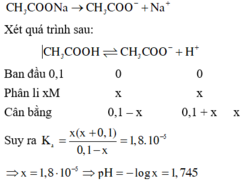

\(NH_3+H_2O⇌NH_4^++OH^-\)
Bđ: 0,05 0,1 0 (M)
Pư: x x+0,1 x (M)
Cb: 0,05-x x+0,1 x (M)
Có: \(\dfrac{\left[NH_4^+\right]\left[OH^-\right]}{\left[NH_3\right]}=K_c\) \(\Rightarrow\dfrac{\left(x+0,1\right).x}{0,05-x}=1,74.10^{-5}\Rightarrow x\approx8,7.10^{-6}\)
⇒ pH = 14 - (-log[OH-]) = 8,94

Đáp án A
TQ : R – H + NaOH → R – Na + H2O
Mol 0,04 ← 0,04
Bảo toàn khối lượng : mX + mNaOH = mH2O + mmuối
=> mmuối = 3,41g
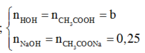
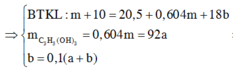
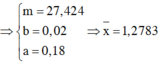
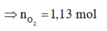
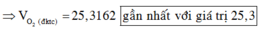
Vì muối CH3COONa là chất điện li mạnh nên ta có
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
Đáp án D.