Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,pH=-log\left[H^+\right]=1\\ b,pH=-log\left[H^+\right]=-log\left[0,1\right]=1\\ c,pH=7\\ d,pH=14-\left(-log\left[OH^-\right]\right)=14-\left(log\left[0,01\right]\right)=12\)
Chọn A và B
Đáp án: A
a, pH = -log[H+] = 1 (HNO3 là axit mạnh nên phân li hoàn toàn)
b, HF là axit yếu, phân ly không hoàn toàn ⇒ [H+] < 0,1 ⇒ pH > 1
c, KCl là muối trung hòa ⇒ pH = 7
d, KOH là bazo mạnh, phân ly hoàn toàn ⇒ pH = 14 - (-log[0,01]) = 12

Đáp án D
C2H5OH ko là chất điện li nên khả năng dẫn điện kém nhất
CH3COOH là chất điện li yếu nên tổng nồng độ các ion < 0,2 mol
NaCl → Na++ Cl-
0,1 0,1 0,1
Tổng nồng độ các ion là 0,2M
K2SO4→ 2K++ SO42-
0,1 0,2 0,1
Tổng nồng độ các ion là 0,3M
Do đó độ dẫn điện C2H5OH<CH3COOH< NaCl < K2SO4

Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
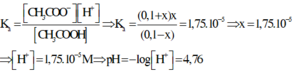
Đáp án D.

Chọn đáp án D
Quy đổi: 0,1 mol H2NCH2COOH + 0,3 mol HCl + NaOH → muối + H2O.
có ![]() mol.
mol.
BTKL có ![]() gam.
gam.
Chọn đáp án D.

\(3.\\ a.\left[H^+\right]=\dfrac{10^{-14}}{\left[OH^-\right]}=\dfrac{10^{-14}}{10^{-5,17}}=10^{-8,83}\left(mol\cdot L^{-1}\right)\\ pH=-log\left[H^+\right]=8,83\)
b. pH > 7: dầu gội có môi trường base
4.
a. pH < 7 nên đó là môi trường acid.
b.
+ Tưới tiêu nước rửa chua.
+ Dùng vôi bột bón cho đất để trung hoà, giảm chua.
+ Bón phân hữu cơ, phân chuồng,...
5.
\(A.pH=-log\left(0,1\right)=1\\ B.pH>1\\ C.pH=7\\ D.pH=-log\left(\dfrac{10^{-14}}{0,01}\right)=12\)
Vậy chọn D.

Đáp án B
Na2O+ H2O→ 2NaOH
0,02 0,02+0,02
NaOH+ HCl→ NaCl + H2O
0,02 0,02
2NaOH dư+ H2SO4→ Na2SO4+ 2H2O
0,02 0,01
Do đó a=mNa2O= 0,02.62= 1,24 gam

A. Dung dịch HCl 0,1 M.