Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(PTHH:Fe+S-^{t^o}>FeS\)
BD 0,21875 0,3125
PU 0,21875--> 0,21875---> 0,21875
CL 0----------->0,09375--->0,2175
\(n_{Fe}=\dfrac{m}{M}=\dfrac{14}{64}=0,21875\left(mol\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{10}{32}=0,3125\left(mol\right)\)
\(\dfrac{n_{Fe}}{1}< \dfrac{n_S}{1}\left(\dfrac{0,21875}{1}< \dfrac{0,3125}{1}\right)\)
=> Fe hết , S dư
\(m_S=n\cdot M=\text{0,09375}\cdot32=3\left(g\right)\)
làm lại (suy ngẫm lại thì mik sai)
\(PTHH:Fe+S-^{t^o}>FeS\)
áp dụng ĐLBTKL ta có
\(m_{Fe}+m_S=m_{FeS}\)
\(=>m_S=m_{FeS}-m_{Fe}\\ =>m_S=22-14\\ =>m_S=8\left(g\right)\)
khối lượng lưu huỳnh đã lấy là
\(10-8=2\left(g\right)\)

\(n_{Mg}=\dfrac{0.48}{24}=0.02\left(mol\right)\)
\(n_{O_2}=\dfrac{0.672}{22.4}=0.03\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^0}2MgO\)
\(0.02...0.01\)
\(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\)
\(0.03...\left(0.03-0.01\right)\)
\(m_{Fe}=0.03\cdot56=1.68\left(g\right)\)
\(m_{hh}=1.68+0.48=2.16\left(g\right)\)

a) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) Gọi x,y là số mol Al, Fe
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Ta có hệ : \(\left\{{}\begin{matrix}27x+56y=0,83\\\dfrac{3}{2}x+y=0,02\end{matrix}\right.\)
=> \(x=\dfrac{29}{5700};y=\dfrac{47}{3800}\)
\(\%m_{Al}=\dfrac{\dfrac{27}{5700}.27}{0,83}.100=16,55\%\); \(\%m_{Fe}=100-16,55=83,45\%\)
c)Bảo toàn nguyên tố H: \(n_{H_2SO_4}=n_{H_2}=0,02\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,02.98}{200}.100=0,98\%\)

a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
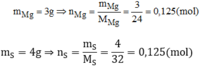
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.

theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng: mfe + ms = mfes khối lượng lưu huỳnh đã hóa hợp với sắt là: ms = mfes – mfe = 44 – 28 = 16(g) khối lượng lưu huỳnh lấy dư: 30 – 16 = 14 (g)

Theo định luật bảo toàn khối lượng, ta có công thức khối lượng của phản ứng:
m F e + m S = m F e S
Khối lượng lưu huỳnh đã hóa hợp với sắt là:
m S = m F e S - m F e = 44 – 28 = 16(g)
Khối lượng lưu huỳnh lấy dư: 20 – 16 = 4 (g)

\(n_{FeS}=\dfrac{44}{88}=0,5\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,5 0,5
\(m_{S\left(dư\right)}=20-32.0,5=4\left(g\right)\)

\(Fe+S\rightarrow FeS\) (1)
a-----a-------a---------(mol)
\(2Al+3S\rightarrow Al_2S_3\) (2)
b------1,5b----0,5b-----(mol)
Ta có hệ PT sau:
\(\left\{{}\begin{matrix}56a+27b=1,1\\32a+48b=1,28\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\)
=> mFe=0,01.56=0,56gam
mAl=0,02.27=0,54gam
\(\%Fe=\dfrac{0,56}{1,1}.100\%\approx51\%=>\%Al=100-51=49\%\)
vậy...
Ta có : \(n_S=\dfrac{m}{M}=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Gọi x, y lần lượt là số mol của Fe và Al trong hỗn hợp
\(\Rightarrow m_{Fe}+m_{Al}=56x+27y=1,10=1,1\left(g\right)\)(1 )
a) PTHH :
Fe + S \(\rightarrow^{t^o}\)FeS
x-----x
2Al + 3S \(\rightarrow^{t^o}Al_2O_3\)
y------1,5y
\(\Rightarrow x+1,5y=0,04\) ( 2 )
Từ ( 1 ) và ( 2 ) , ta có hệ phương trình :
\(\left\{{}\begin{matrix}56x+27y=1,1\\x+1,5y=0,04\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
b) Tỉ lệ phần trăm của sắt và nhôm trong hỗn hợp ban đầu :
* Theo lượng chất
\(\%n_{Fe}=\dfrac{0,01\cdot100\%}{0,01+0,02}=33,33\%\)
\(\%n_{Al}=\dfrac{0,02\cdot100\%}{0,01+0,02}=66,67\%\)
* Theo khối lượng chất
\(\%m_{Fe}=\dfrac{m_{Fe}\cdot100\%}{m_{hh}}=\dfrac{0,01\cdot56\cdot100\%}{1,1}=51\%\)
\(\%m_{Al}=100\%-\%Fe=100\%-51\%=49\%\)
Mong là đúng