Nguyên tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguyên tử nguyên tố Y có electron cuối cùng thuộc phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học trong hợp chất X – Y là:
A. Sự góp chung đôi electron.
B. Sự góp đôi electron từ một nguyên tử.
C. Sự tương tác yếu giữa hai nguyên tử có chênh lệch độ âm điện lớn.
D. Lực hút tĩnh điện giữa hai ion trái dấu



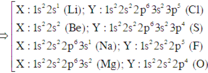
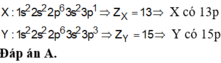

Đáp án D
X có e cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II).
Y có e cuối thuộc phân lớp p ⇒ nhóm A (III → VIII).
eX + eY = 20 ⇒ pX + pY = 20
Ta có: X chỉ có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19).
⇒ Ta thấy chỉ có Na (p = 11) ⇒ pY = 9 (Flo) thỏa mãn.
⇒ X - Y: NaF (liên kết ion)